
| A. | 氯化钠 | B. | 氯气 | C. | 小苏打 | D. | 明矾 |
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
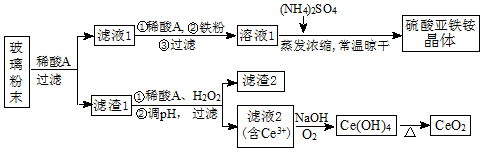
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 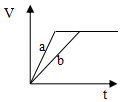 | B. | 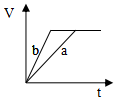 | C. | 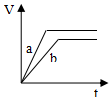 | D. | 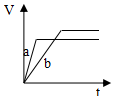 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4O2 | B. | C3H6O3 | C. | C4H6O4 | D. | C6H12O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子云中的每个小黑点代表一个电子 | |
| B. | σ键采用“肩并肩”的重叠方式 | |
| C. | 含有配位键的化合物就叫配合物 | |
| D. | 血红素、叶绿素、维生素B12都是配合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组别 | 甲 | 乙 | 丙 |
| A | Al2O3 | HNO3 | NaOH |
| B | N2 | O2 | NH3 |
| C | SiO2 | KOH | HF |
| D | SO2 | Ba(OH)2 | NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤操作中,玻璃棒与三层滤纸 | |
| B. | 过滤操作中,漏斗下端与烧杯内壁 | |
| C. | 加热试管内物质时,试管底部与酒精灯灯芯不接触 | |
| D. | 用胶头滴管向试管中滴加液体时,滴管尖端与试管内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com