
| A. | 原子序数:d>c>b>a | B. | 原子半径:r (A)>r (B)>r (D)>r (C) | ||
| C. | 单质的还原性:A>B>D>C | D. | 离子半径:r (C3-)>r (D-)>r (B+)>r (A2+) |
分析 已知短周期元素的离子,aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则离子核外电子数相同,即a-2=b-1=c+3=d-1,原子序数A>B>D>C,A、B处于同一周期,C、D处于同一周期,且A、B处于C、D所在周期的相邻下一周期,A、B形成阳离子,则A、B为金属,C、D形成阴离子,则C、D为非金属.结合元素周期律进行解答.
解答 解:已知短周期元素的离子,aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则离子核外电子数相同,即a-2=b-1=c+3=d-1,原子序数A>B>D>C,A、B处于同一周期,C、D处于同一周期,且A、B处于C、D所在周期的相邻下一周期,A、B形成阳离子,则A、B为金属,C、D形成阴离子,则C、D为非金属.
A.aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则离子核外电子数相同,即a-2=b-1=c+3=d-1,原子序数a>b>d>c,故A错误;
B.aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则离子核外电子数相同,即a-2=b-1=c+3=d-1,原子序数A>B>D>C,A、B处于同一周期,C、D处于同一周期,且A、B处于C、D所在周期的相邻下一周期,同周期,原子序数越大原子半径越小,所以原子半径B>A,C>D,电子层越大原子半径越大,所以原子半径B>A>C>D,故B错误;
C.A、B处于同一周期,A、B形成阳离子,则A、B为金属,原子序数A>B,单质还原性B>A,故C错误;
D.电子层结构相同,核电荷数越大,离子半径越小,核电荷数A>B>D>C,所以离子半径C3->D->B+>A2+,故D正确.
故选D.
点评 本题考查位置结构性质的相互关系及应用,本题根据核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
| 热化学方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| ①2H2(g)+CO(g)?CH3OH(g)△H1=a kJ•mol-1 | 2.5 | 0.2 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g)△H2=b kJ•mol-1 | 1.0 | 2.3 |
| ③3H2(g)+CO2 (g)?CH3OH(g)+H2O(g)△H3=c kJ•mol-1 | K3 | 4.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
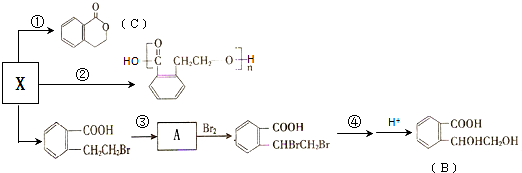
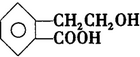 ,它可通过不同化学反应分别制得B、C、D 和E四种物质.
,它可通过不同化学反应分别制得B、C、D 和E四种物质.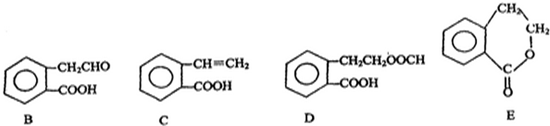
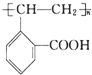 .
. +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 沉淀H为Al(OH)3、BaCO3的混合物 | |
| B. | 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl- | |
| C. | 溶液X中一定含有Al3+、NH4+、Fe2+、SO42-、H+ | |
| D. | 若溶液X为100 mL,产生的气体A为44.8 mL(标况),则X中c(Fe2+)=0.06 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | B. | 原子半径:X>Y>Z | ||
| C. | 非金属性:X>Y>Z | D. | 单质氧化性:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
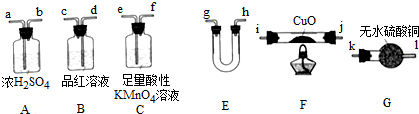
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
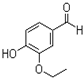 乙基香兰素是一种合成香料,其结构简式如图:
乙基香兰素是一种合成香料,其结构简式如图: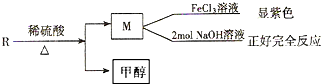
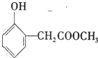 、
、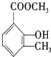 ;
;
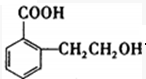 ;B中含氧官能团的名称羟基、羧基;
;B中含氧官能团的名称羟基、羧基; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com