
 |  |  |  |
| A.锌锰碱性电池 | B.硅太阳能电池 | C.氢燃料电池 | D.银锌纽扣电池 |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:解答题
 .
. →
→ ,元素⑥和⑨形成的化合物中含有离子键.
,元素⑥和⑨形成的化合物中含有离子键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 48 mol•(L•s )-1 | B. | 36 mol•(L•s )-1 | C. | 24 mol•(L•s )-1 | D. | 12 mol•(L•s )-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ① | ⑦ | ④ | ||||
| 3 | ③ | ⑤ | ⑧ | ⑩ | ||||
| 4 | ② | ⑨ |
 ;
; .
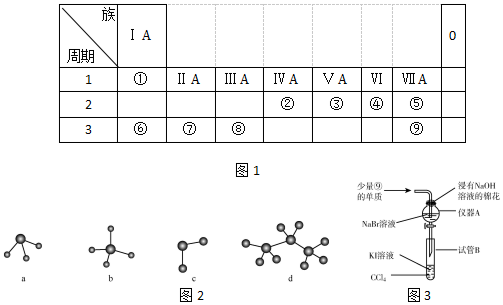
. ;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
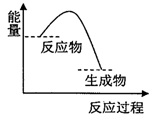
| A. | 该反应过程中,形成新化学键释放的总能量小于断裂旧化学键吸收的总能量 | |
| B. | 因为生成物的总能量低于反应物的总能量,所以该反应不需要加热即可进行 | |
| C. | 该图象可以表示碳酸钙受热分解的能量变化 | |
| D. | 该图象可以表示锌与稀硫酸反应的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 92g乙醇与足量的金属钠反应,生成氢气(H2)的分子数为NA | |
| C. | 标准状况下,22.4L已烷中碳碳键数目为5NA | |
| D. | 乙烯和甲醚的混合物共0.1mol,完全燃烧所消耗的氧分子数一定为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 33% | C. | 50% | D. | 89% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液洗气时发生反应的离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O | |
| B. | 根据实验可以得出中性条件下,氧化性Cl2>O2 | |
| C. | 根据实验可以得出反应物的浓度和溶液的pH会影响物质的氧化性 | |
| D. | 当电路中通过2mol电子时,阳极可收集到标准状况下气体体积为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com