
铁、稀盐酸、澄清石灰水、氯化铜溶液是常见的物质,四种物质间的反应关系如图所示。图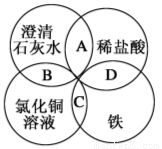 中两圆相交部分(A、B、C、D)表示物质间的
中两圆相交部分(A、B、C、D)表示物质间的 反应,其中对应反应的离子方程式书写正确的是
反应,其中对应反应的离子方程式书写正确的是
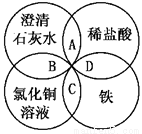
A.OH-+HCl=H2O+Cl-
B.Ca(OH)2+Cu2+=Ca2++Cu(OH)2
C.Fe+Cu2+=Cu+Fe2+
D.Fe+2H+=Fe3++H2↑
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年山西省高二上11月月考化学卷(解析版) 题型:选择题
常温下,向0.1 mol·L-1的硫酸溶液中逐渐加入物质的量浓度相同的的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是

A.溶液的pH:a<b<c<d B.溶液的导电能力:a>b>d>c
C.a、b溶液呈酸性 D.c、d溶液呈碱性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆哈密二中高二上期中化学试卷(解析版) 题型:选择题
已知反应:①101kPa时,2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol
下列结论正确的是
A.碳的燃烧热是110.5kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ /mol
/mol
D.稀盐酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团二师华山中学高一期中化学卷(解析版) 题型:实验题
用Na2CO3·10H2O晶体,配制0.2 mol·L-1的Na2CO3溶液480 mL。
(1) 应称取Na2CO3·10H2O晶体的质量: 。
(2) 根据下列操 作对所配溶液的浓度产生的影响,完成下列要求:
作对所配溶液的浓度产生的影响,完成下列要求:
① Na2CO3·10H2O晶体失去了部分结晶水
② 用“左码右物”的称量方法称量晶体(使用游码)
③ 碳酸钠晶体不纯,其中混有氯化钠
④ 称量碳酸钠晶体时所用砝码生锈
⑤ 容量瓶未经干燥使用
⑥ 定容时俯视容量瓶刻度线
其中引起所配溶液浓度偏高的有 (填序号,下同),偏低的有 ,无影响的有 。
(3)下列操作中,容量瓶所不具备的功能有 。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团二师华山中学高一期中化学卷(解析版) 题型:选择题
下列叙述正确的是
A.1 L水中溶解了40 g NaOH后,所得溶液浓度为1 mol/L
B.从1 L 2 mol/L的NaCl溶液中取出0.5 L,该溶液的浓度为1 mol/L
C.将2.24 L(标准状况)HCl气体溶于水制成100 mL溶液,其物质的量浓度为1 mol/L
D.配制1 L 0.2 mol/L的CuSO4溶液,需用32g胆矾
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团二师华山中学高一期中化学卷(解析版) 题型:选择题
下列关于胶体和溶液的说法中正确的是
A.胶体不均一、不稳定,静置后易产生沉淀,溶液均一、稳定、静置不产生沉淀
B.溶液和胶体都是纯净物,浊液是混合物
C.光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应
D.只有胶状物如胶水、果冻类的物质才能称为胶体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团二师华山中学高二期中化学卷(解析版) 题型:填空题
对于A+2B(气) nC(气)在一定条件下达到平衡后,改变下列条件,请回答:
nC(气)在一定条件下达到平衡后,改变下列条件,请回答:
(1)A量的增加或减少,平衡不移动,则A为_________态。
(2)增压,平衡不移动,当n=2时,A的状态为___________;当n=3时,A的状态为_________。
(3)若A为固体,增大压强,C的组分含量减少,则n的取值范围___________。
(4)升温,平衡向右移动,则该反应的逆反应为___________反应。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上学期月考二化学卷(解析版) 题型:填空题
(12分)
Ⅰ.某温度下,0.1 mol/L的氢硫酸溶液中存在平衡:
①H2S(aq) H+(aq)+HS-(aq);②HS-(aq)
H+(aq)+HS-(aq);②HS-(aq) H+(aq)+S2-(aq);
H+(aq)+S2-(aq);
(1)氢硫酸溶液中存在的离子有 。(不完整不给分)
(2)若向H2S溶液中( )
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH增大
C.滴加新制氯水,平衡向左移动,溶液pH减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
Ⅱ.25℃时,部分物质的电离平衡常数如表所示:
化学式 | C | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH的电离平衡常数表达式 。
(2)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为 。
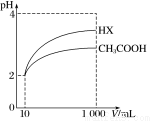
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数 (填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是 。
Ⅲ.在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH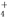 )=c(Cl-),则溶液显 性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
)=c(Cl-),则溶液显 性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上期中化学卷(解析版) 题型:选择题
某50 mL溶液中可能含有H+、Na+、Mg2+、Al3+、SO42-、NH4+离子,当向该溶液中加入5 mol/L的NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积v(NaOH)变化关系如下图所示。
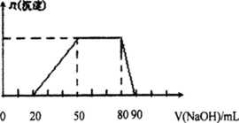
A.原溶液中一定含有的阳离子是H+、Mg2+、Al3+、SO42-
B. 原溶液中Al3+的浓度为lmol/L
C. 原溶液中NH4+的物质的量为0.4 mol
D. 当加入的NaOH溶液的体积为90mL时,反应后溶液中的离子只有Na+和SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com