
250C时,pH=3的HNO3,下列该硝酸说法正确的是
A.该硝酸中水电离出的c(H+)=1.0×10-3mol/L
B.加水稀释到原溶液体积的100倍,硝酸溶液的pH为5
C.相同温度下,pH=3的CH3COOH溶液的物质的量浓度与该硝酸相同
D.该硝酸中加入少量的Zn粒产生H2
科目:高中化学 来源:2014高考名师推荐化学物质的量及阿伏伽德罗常数(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.在标况下,11.2 L NO与11.2 L O2混合后所含分子数为0.75NA
B.常温常压下,16 g O3所含的电子数为8NA
C.0.1 mol Na2O2晶体中含有0.4NA个离子
D.铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学燃烧热与盖斯定律(解析版) 题型:实验题
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO3)2、NO2、O2
乙:MgO、NO2、O2
丙:Mg3N2、O2
丁:MgO、NO2、N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是 。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
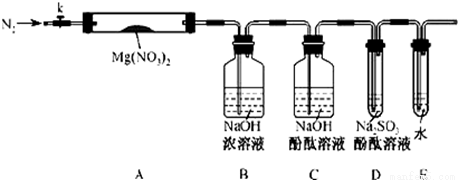
(2)实验过程
①取器连接后,放人固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E 中有气泡连续放出,表明 。
②称取Mg(NO3)2固体3.79 g置于A中,加热前通人N2以驱尽装置内的空气,其目的是 ;关闭K,用酒精灯加热时,正确操作是先 然后固定在管中固体部位下加热。
③观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g⑤ 取少量剩余固体于试管中,加人适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想 是正确的。
②根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应: (填写化学方程式),溶液颜色会退去;小组讨论认定分解产物中有O2存在,未检侧到的原因是 。
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装里进一步研究。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学溶度积、沉淀的生成、溶解、转化(解析版) 题型:选择题
一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时。已知下表数据
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp(25 ℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH值 | ≥9.6 | ≥6.4 | 3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是
A.向该溶液中加少量铁粉不能观察到红色固体析出
B.该溶液中c(SO):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4
C.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
D.向该溶液中加入适量氯水,并调节pH值到3~4后过滤,得到纯净的CuSO4溶液
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学溶度积、沉淀的生成、溶解、转化(解析版) 题型:选择题
下列说法正确的是
A.反应2Mg+CO22MgO+C ΔH<0从熵变角度看,可以自发进行
B.在密闭容器发生可逆反应:2NO(g)+2CO(g)  N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小
N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小
C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生
D.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学水的电离与溶液酸碱性(解析版) 题型:选择题
室温下,下列关于pH均为9、体积均为10 mL的NaOH溶液和CH3COONa溶液的说法,正确的是
A.两种溶液中的c(Na+)相等
B.分别加热到相同温度时,CH3COONa溶液的pH小
C.分别加水稀释到100 mL时,两种溶液的pH依然相等
D.两溶液中由水电离出的c(OH-)之比为10-9/10-5
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氯、溴、碘及其化合物主要性质(解析版) 题型:选择题
已知X、Y在一定条件下发生反应,可以得到E、F、G。下列假设与结论能对应成立的是
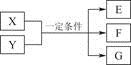
选项 | 假设 | 结论 |
A | 若X、Y均为固体,E为气体 | 则E一定能使湿润的蓝色石蕊试纸变红 |
B | 若该反应是氯碱工业的主要反应,反应一段时间后 | 两极产生的气体体积可能不同(不考虑气体的溶解) |
C | 若X为单质,Y为氧化性酸,气体E是能引起酸雨的主要物质 | 则Y一定是浓H2SO4 |
D | 若X为有机物,得到E是一种红色沉淀 | 则X一定是醛 |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氨及铵盐(解析版) 题型:填空题
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。
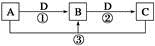
请回答下列问题:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是 ;工业上制取A的离子方程式 。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为 。
(3)若D是氯碱工业的主要产品之一,B有两性,则反应②的离子方程式是 。
(4)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为 。
某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因: 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氧、硫及其化合物主要性质(解析版) 题型:选择题
下图所示的是验证二氧化硫性质的微型实验,a、b、c、d是浸有相关溶液的棉球。将硫酸滴入装有亚硫酸钠固体的培养皿中。
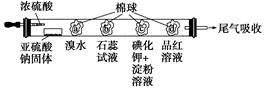
关于此实验的“现象”、“解释或结论”以及对应关系均正确的是
选项 | 现象 | 解释或结论 |
A | a处黄色褪去 | 非金属性:Br>S |
B | b处变为红色 | 二氧化硫与水反应生成酸性物质 |
C | c处变为蓝色 | 二氧化硫具有一定的氧化性 |
D | d处红色先褪去后恢复 | 二氧化硫具有漂白性且漂白性不稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com