
分析 Ⅰ、(1)沉淀是CuCO3说明,Na2CO3溶液与CuSO4溶液发生反应生成硫酸钠与碳酸铜,即碳酸根与铜离子反应生成碳酸铜沉淀;
Ⅱ、利用加热的方法检验,氢氧化铜和碳酸铜加热分解得到氧化铜、水和二氧化碳,若有氢氧化铜可用无水硫酸铜检验,若有碳酸铜可用澄清的石灰水检验产生的二氧化碳,澄清石灰水变浑浊说明含有CuCO3;
Ⅲ、(5)实验开始时装置的空气中会有水蒸气和二氧化碳,若不排除被吸收装置吸收会对计算结果产生较大的误差,故开始时先用除去水和二氧化碳的空气将装置中的水蒸气和二氧化碳排除(注意实验结束氢氧化铜和碳酸铜加热分解后会在反应装置中残留二氧化碳和水蒸气,也应通过用除去水和二氧化碳的空气将装置中的水蒸气和二氧化碳赶出被吸收装置完全吸收);
(6)实验开始时装置的空气中会有水蒸气和二氧化碳,若不排除被吸收装置吸收会对计算结果产生较大的误差,故开始时先用除去水和二氧化碳的空气将装置中的水蒸气和二氧化碳排除;
实验结束氢氧化铜和碳酸铜加热分解后会在反应装置中残留二氧化碳和水蒸气,通过用除去水和二氧化碳的空气将装置中的水蒸气和二氧化碳赶出被吸收装置完全吸收;
(7)装置B质量增加了n克,说明分解生成ng水,根据水的质量计算沉淀中氢氧化铜的质量,沉淀质量减去氢氧化铜的质量等于碳酸铜的质量,再利用质量分数的定义计算.
解答 解:Ⅰ、(1)沉淀是CuCO3说明,Na2CO3溶液与CuSO4溶液发生反应生成硫酸钠与碳酸铜,即碳酸根与铜离子反应生成碳酸铜沉淀,反应离子方程式为CO32-+Cu2+=CuCO3↓,故答案为:CO32-+Cu2+=CuCO3↓;
Ⅱ、(3)利用加热的方法检验,氢氧化铜和碳酸铜加热分解得到氧化铜、水和二氧化碳,若有氢氧化铜可用无水硫酸铜检验,若有碳酸铜可用澄清的石灰水检验产生的二氧化碳,故答案为:无水硫酸铜固体;
(4)用澄清的石灰水检验是否产生二氧化碳,装置C中澄清石灰水变浑浊,说明生成二氧化碳,即说明含有CuCO3.
故答案为:装置C中澄清石灰水变混浊;
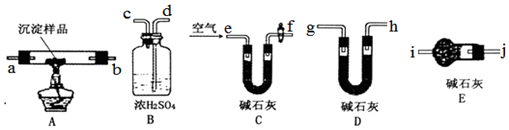
Ⅲ、(5)若CuCO3和Cu(OH)2两种沉淀都有,加热时生成CO2和H2O,定量检验时,可用浓硫酸吸收水,用碱石灰吸收二氧化碳,实验时,为减小误差,应排除空气中水和二氧化碳的干扰,并保证水和二氧化碳完全吸收,则实验仪器的连接顺序应为e→f→a→b→d→c→g→h→j(或者a、b可以互换;g、h可以互换),故答案为:a→b→d→c→g→h(或者a、b可以互换;g、h可以互换);
(6)实验开始时装置的空气中会有水蒸气和二氧化碳,若不排除被吸收装置吸收会对计算结果产生较大的误差,故开始时先用除去水和二氧化碳的空气将装置中的水蒸气和二氧化碳排除,故装置C中碱石灰的作用是吸收空气中的H2O 蒸汽和CO2;
氢氧化铜和碳酸铜加热分解后会在反应装置中残留二氧化碳和水蒸气,通过用除去水和二氧化碳的空气将装置中的水蒸气和二氧化碳赶出被吸收装置完全吸收,防止影响测定结果.
故答案为:吸收空气中的H2O 蒸汽和CO2;将装置中滞留的气体赶出,使其充分被吸收;
(7)装置B质量增加了n克,说明分解生成ng水,水的物质的量为$\frac{n}{18}$mol,根据氢元素守恒可知氢氧化铜的物质的量为$\frac{n}{18}$mol,故氢氧化铜的质量为$\frac{n}{18}$mol×98g/mol=$\frac{49n}{9}$g,沉淀中CuCO3的质量为(m-$\frac{49n}{9}$)g,碳酸铜的质量分数为=$\frac{m-\frac{49n}{9}}{m}$×100%=(1-$\frac{49n}{9m}$)×100%,
故答案为:(1-$\frac{49n}{9m}$)×100%.
点评 本题考查对实验方案设计与装置的理解、实验基本操作、化学计算等,难度中等,理解实验原理是解题的关键,是对知识的综合运用,需要学生具备扎实的基础知识与运用知识分析问题、解决问题的能力.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 由2H和18O所组成的水11g,其中所含的中子数为5NA | |
| B. | 3NA个NO2分子跟水分子充分作用,转移(偏移)的电子数为2NA | |
| C. | 标准状况下,11.2 L的氧气和氮气的混合物含有的分子数约为NA | |
| D. | 62g白磷晶体中,含2NA个P-P键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液一定呈酸性 | B. | 该溶液中的c(H+)可能等于10-3 | ||
| C. | 该溶液的pH可能为2,可能为12 | D. | 该溶液有可能呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若二氧化碳气体中混有少量的一氧化碳气体,可用点燃的方法除去 | |
| B. | 将铜粉中混有的少量铁粉除去,加入过量的CuSO4溶液充分反应后,过滤、洗涤干燥 | |
| C. | 将KNO3固体中混有的少量NaCl固体除去,可以用冷却KNO3的热饱和溶液、过滤即可 | |
| D. | 若氧气中混有少量的二氧化碳气体,可将混合气体通过足量的NaOH溶液后干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe═Fe2++2e- | B. | Cu2++2e-═Cu | C. | Fe═Fe3++3e- | D. | Zn═Zn2++2e- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
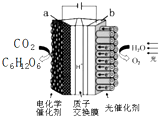 中关村“创客19”实验室模拟光合作用的电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和葡萄糖(C6H12O6).下列说法正确的是( )
中关村“创客19”实验室模拟光合作用的电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和葡萄糖(C6H12O6).下列说法正确的是( )| A. | 该装置是新型化学电源装置 | |
| B. | 该装置工作时,H+从a极区向b极区迁移 | |
| C. | 每生成1 mol O2,有44 g CO2被还原 | |
| D. | a 电极的反应为:6CO2+24H+-24e-=C6H12O6+6 H2 O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 g质量分数为98%的浓硫酸中所含有的氧原子数为4 NA | |
| B. | 足量的Fe与6.72 L Cl2反应转移的电子数为0.6 NA | |
| C. | 密闭容器中1 molN2与4 molH2反应生成的NH3分子数小于2NA | |
| D. | 3 g乙烷含有共用电子对为0.6 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com