
【题目】常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_________________________。
(2)若溶液M由10mL 2 mol·L-1NaHA溶液与10mL 2mol·L-1NaOH溶液混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为__________________________。(溶液混合时体积变化忽略,下同)
(3)已知Ksp(BaA)= 1.8×10-10,向⑵的混合溶液中加入10mL 1 mol·L-1 BaCl2溶液,混合后溶液中的Ba2+浓度为___________ mol·L-1。
(4)25℃时,amol/L氨水和0.01mol/L盐酸等体积混合充分反应后,c(NH4+)= c(Cl-)求一水合氨的电离常数K= _____________
【答案】H2A ![]() H++HA HA
H++HA HA![]() H++A2 > c(Na+)>c(A2)>c(OH)>c(HA)>c(H+) 5.4×1010
H++A2 > c(Na+)>c(A2)>c(OH)>c(HA)>c(H+) 5.4×1010 ![]()
【解析】
多元弱酸电离一步一步电离,混合溶液先找出溶质,再分析溶液酸碱性,再分析离子浓度大小关系,加离子沉淀,先将离子沉淀后求剩余的离子浓度,再通过Ksp来计算所求离子的浓度大小,混合后求平衡常数,一定找出平衡常数所涉及到的离子浓度,一定注意体积变化,浓度发生改变。
⑴根据题中信息得出酸H2A为二元弱酸,其电离方程式H2A![]() H++HA,HA
H++HA,HA![]() H++A2,
H++A2,
故答案为H2A![]() H++HA,HA
H++HA,HA![]() H++A2;
H++A2;
⑵若溶液M由10mL 2 mol·L-1NaHA溶液与10mL 2mol·L-1NaOH溶液混合得到溶质为Na2A,M要发生水解,故溶液M的pH > 7,溶液中水解离子方程式A2+H2O![]() OH + HA,HA+H2O
OH + HA,HA+H2O![]() OH+ H2A,H2O
OH+ H2A,H2O![]() H+ + OH,溶液中离子浓度由大到小顺序为c(Na+)>c(A2)>c(OH)>c(HA)>c(H+);
H+ + OH,溶液中离子浓度由大到小顺序为c(Na+)>c(A2)>c(OH)>c(HA)>c(H+);
故答案为>;c(Na+)>c(A2)>c(OH)>c(HA)>c(H+);
⑶已知Ksp(BaA)= 1.8×10-10,向⑵的混合溶液中加入10mL 1 mol·L-1 BaCl2溶液,
A2- + Ba2+ ==BaA↓
1mol 1mol
0.02mol 0.01mol
两者反应生成沉淀,剩余n(A2) =0.01 mol,![]() ,
,
混合后溶液中的Ba2+浓度为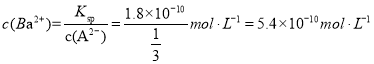 ,
,
故答案为5.4×1010;
⑷25℃时,a mol/L氨水和0.01mol/L盐酸等体积混合充分反应后,
c(NH4+)= c(Cl) =0.005 mol/L,c(H+) = c(OH-),则一水合氨的电离常数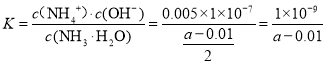
故答案为![]() 。
。


科目:高中化学 来源: 题型:
【题目】某课外活动小组设计如图实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”.

(1)过氧化钠与水反应的化学方程式是__.
(2)装置I是制备纯净的__(填化学式).则装置I中最适宜的试剂组合是__(填字母).
a.稀盐酸 b.稀硫酸 c.小苏打 d.石灰石
(3)实验时,应先打开弹簧夹K2,关闭K1,观察到预期现象后,打开K1,再关闭K2.
(4)实验过程中将带火星的木条置于a口,观察到带火星的木条始终不复燃.
①为观察到最终木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是__;
②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请综合运用所学知识,填写下列空白:
(1)①中和热测定实验中,除了烧杯、温度计、泡沫塑料、泡沫塑料板外,还需要使用的仪器有_____。
②下列关于中和热的说法正确的是______
A.用稀硫酸和Ba(OH)2溶液代替盐酸与NaOH溶液进行中和热测定,如果准确操作,所测中和热数值可以相同
B.测定中和热时,为保证酸碱充分反应,应将碱溶液缓慢分次倒入酸溶液中,并充分搅拌
C.测定中和热时,温度计测量盐酸溶液的温度后,用蒸馏水洗净再测NaOH溶液温度,实验准确度更高
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等
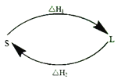
(2)①某反应历程,假设体系的始态为S,终态为L,它们之间的变化用两段弧线(可以包含任意数目的中间步骤)连接如图所示,则△H1+△H2=______。
②已知C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=_______。
(3)①用如图所示装置,在一定条件下讨论锌与稀硫酸的反应速率时,采用一些方法测定了下列物理量,其中可以用于表示(或计算)其化学反应速率的是______
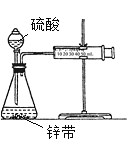
A.收集10mL H2所用的时间 B.一定时间内收集H2的体积
C.一定时间内溶液中H+的浓度变化 D.一定时间内锌粒质量的变化
E.一定时间内反应热量的变化
②为加快一定量的Zn与足量稀硫酸反应的速率,且不影响生成H2的总量,下列措施可行的是_____
A.加入少量CuSO4溶液 B.对反应液适当加热
C.将稀硫酸换成浓硫酸 D.将锌粒换成锌粉
(4)反应a M(g)+a N(g)![]() b W(g)+c Z(g),在体积相同且恒定的两个容器中,按照下列方式加入原料,一段时间后达到平衡:
b W(g)+c Z(g),在体积相同且恒定的两个容器中,按照下列方式加入原料,一段时间后达到平衡:
开始时 | 平衡时 | |||
容器1 | 2mol M | 1mol N | 总压P1 | 0.5mol W |
容器2 | 1mol M | 2mol N | 总压P2 | x mol W |
则x=____,P1_____P2(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有物质的量浓度均为0.1 mol/L的溶液①NH3·H2O ②CH3COOH ③KHSO4。下列有关离子浓度分析一定不正确的是( )
A.向①中逐滴加入少量②,![]() 逐渐增大
逐渐增大
B.①、③等体积混合后溶液中存在:NH4+ +H2O![]() NH3·H2O+H+
NH3·H2O+H+
C.①、②任意比混合:c(CH3COO-)+c(OH-)=c(H+)+c(NH4+ )
D.①、③按体积比2:1混合:c(NH4+)>c(NH3H2O)>c(SO42-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是碳酸钙(CaCO3)在25 ℃和100 ℃两种情况下,在水中的溶解平衡曲线。下列有关说法正确的是
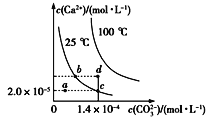
A. CaCO3(s)![]() Ca2+(aq)+ CO32-(aq) ΔH<0
Ca2+(aq)+ CO32-(aq) ΔH<0
B. a、b、c、d四点对应的溶度积Ksp相等
C. 温度不变,蒸发水,可使溶液由a点变到c点
D. 25 ℃时,CaCO3的Ksp=2.8×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各组物质中,找出合适的序号填在对应的空格内:
①白磷和红磷;②NO2和N2O4;③12C和14C;④![]() 和
和 ![]() ;⑤C60和金刚石;⑥异戊烷和新戊烷 ;⑦
;⑤C60和金刚石;⑥异戊烷和新戊烷 ;⑦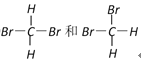
(1)互为同位素的是_____________;
(2)互为同分异构体的是__________;
(3)互为同素异形体的是_________;
(4)同一物质的是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将总物质的量为nmol的钠和铝的混合物(其中钠的物质的量分数为x)投入到一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体VL。下列关系式正确的是( )
A.x=![]()
B.0<x<0.5
C.V=33.6n(1-x)
D.11.2n<V≤22.4n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有说法不正确的是( )
A.金属的六方最密堆积和面心立方最密堆积的空间利用率最高
B.钠晶胞结构如图,钠晶胞中每个钠原子的配位数为8

C.温度升高,金属的导电性将变小
D.干冰晶体熔化时,1mol干冰要断裂2mol碳氧双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能用勒夏特列原理解释的是
A.使用铁触媒,加快合成氨反应速率
B.过量空气有利于SO2转化为SO3
C.打开汽水瓶盖,即有大量气泡逸出
D.将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com