
| A. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| B. | Y的简单气态氢化物的热稳定性比W的弱 | |
| C. | 由X、Y组成的物质与由Y、W组成的物质化合,可能发生氧化还原反应 | |
| D. | 常温下,Z的单质一定易溶于由X、Y、W三种元素组成的化合物的溶液 |
分析 X、Y、Z、W是原子序数依次增大的短周期主族元素.Y与W同主族,Z所在的族序数等于周期数,则Z为第三周期第ⅢA族元素,Z为Al元素;X、Y最外层电子数之和为7;X、Z原子的电子数总和与Y、W原子的电子数总和之比为7:12,设X的最外层电子数为x,Y的最外层电子数为y,则$\left\{\begin{array}{l}{x+y=7}\\{\frac{x+13}{2+y+2+8+y}=\frac{7}{12}}\end{array}\right.$,解得x=1,y=6,则X为H,Y为O,W为S,以此来解答.
解答 解:由上述分析可知,X为H,Y为O,Z为Al,W为S,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:r(X)<r(Y)<r(W)<r(Z),故A错误;
B.非金属性Y>W,则Y的简单气态氢化物的热稳定性比W的强,故B错误;
C.由X、Y组成的物质为H2O2,与由Y、W组成的物质SO2化合,可发生氧化还原反应生成硫酸,故C正确;
D.常温下,Z的单质为Al,由X、Y、W三种元素组成的化合物为硫酸,如为浓硫酸,发生钝化不能溶解Al,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子序数、元素的位置、原子结构推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定 | |
| B. | 不同的气体,若体积相同,则它们所含的分子数必相同 | |
| C. | 气体的摩尔体积是指1mol任何气体所占的体积都是22.4L | |
| D. | 恒温恒压条件下,反应前后气体的体积之比等于气体的物质的量之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
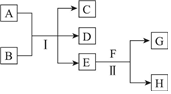 A~H为中学化学中几种常见物质,它们之间的转化关系如图所示.常温下,A和G均为单质气体,同体C常用作干燥剂,E为无色、无味的液体,F为淡黄色粉末.回答下列问题:
A~H为中学化学中几种常见物质,它们之间的转化关系如图所示.常温下,A和G均为单质气体,同体C常用作干燥剂,E为无色、无味的液体,F为淡黄色粉末.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | nCH2=CH2$\stackrel{催化剂}{→}$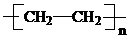 | |
| B. | CH2=CH2+Br2→CH3CHBr2 | |
| C. | 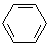 +HNO3$→_{60℃}^{浓硫酸}$ +HNO3$→_{60℃}^{浓硫酸}$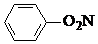 +H2O +H2O | |
| D. | CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH3CH2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
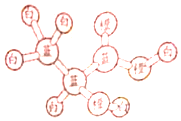 某有机物分子的球棍模型如图所示,图中“棍”代表化学键,不同颜色的“球”代表不同元素的原子,下列说法错误的是( )
某有机物分子的球棍模型如图所示,图中“棍”代表化学键,不同颜色的“球”代表不同元素的原子,下列说法错误的是( )| A. | 1mol该有机物可与2molNa反应,生成1mol气体 | |
| B. | 该有机物可以发生加聚反应 | |
| C. | 该有机物可以发生取代反应,氧化反应、酯化反应 | |
| D. | 该有机物可以生成分子式为C6H8O4的酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q、R的最高价氧化物对应水化物间可反应 | |
| B. | Y的简单氢化物比Z的简单氢化物稳定 | |
| C. | 可通过电解熔融氯化物的方法制备Q、R | |
| D. | X元素单质在化学反应中只表现还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
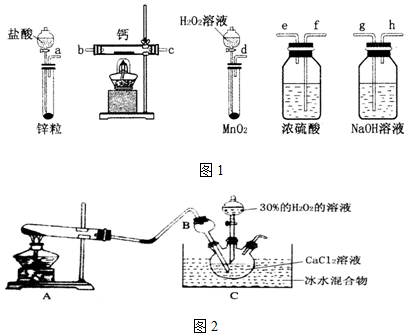
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中只含共价键 | |
| B. | 离子化合物中可能含有共价键 | |
| C. | 干冰变为二氧化碳气体,因共价键被破坏需吸收能量 | |
| D. | 碳酸氢铵受热分解产生氨气不仅破坏离子键还破坏了共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com