
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
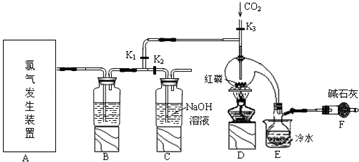
分析 实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3流程为:A装置浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,制得氯气,因PCl3遇水会强烈水解,所以氯气需干燥,B装置利用浓硫酸干燥氯气,利用二氧化碳排尽装置中的空气,防止黄磷(白磷)自燃,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应,
(1)A装置中二氧化锰和浓盐酸反应制取氯气,据此书写离子反应方程式;
(2)氯气为酸性气体,需用酸性干燥剂干燥,三氯化磷沸点低,可用冷水冷凝收集;
(3)防止PCl3与O2等发生副反应,通入二氧化碳赶净空气;
(4)依据物质的沸点数值不同,可以利用蒸馏的方法分离出三氯化磷;
(5)n(NaOH)=1mol/L×0.3L=0.3mol/L,根据转移电子守恒得n(C1-)=n(ClO-)+5n(ClO3-),根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,根据氯原子守恒2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3)计算氯气量;利用极限法解答,根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,转移电子数最少,氧化产物只有NaClO3,转移电子数最多.
解答 解:实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3流程为:A装置浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,制得氯气,因PCl3遇水会强烈水解,所以氯气需干燥,B装置利用浓硫酸干燥氯气,K3利用二氧化碳排尽装置中的空气,防止黄磷(白磷)自燃,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应,
(1)A装置中,加热条件下,浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)因PCl3遇水会强烈水解,所以氯气需干燥,氯气和浓硫酸不反应,所以能用浓硫酸干燥氯气,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应,
故答案为:浓硫酸;冷凝PCl3防止其挥发便于收集产品;
(3)通入一段时间的CO2可以排尽装置中的空气,防止PCl3与O2等发生副反应,
故答案为:排尽曲颈瓶中的空气,防止PCl3与O2等发生副反应;
(4)由信息可知,POCl3与PCl3都是液体,沸点相差较大,故可以用蒸馏的方法进行分离,实验制得的粗产品中常含有POCl3、PCl5等,加入红磷加热除去PCl5后,再通过蒸馏即可得到较纯净的PCl3;
故答案为:蒸馏;
(5)n(NaOH)=1mol/L×0.3L=0.3mol/L,根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO时转移电子数最少,为0.3mol×$\frac{1}{2}$×1=0.15mol,
氧化产物只有NaClO3时,转移电子数最多,为0.3mol×$\frac{5}{6}$×1=0.25mol,反应中转移电子的物质的量(n)的范围是0.15mol<n<0.25mol;
故答案为:0.15mol<n<0.25mol.
点评 本题考查制备方案的设计,题目难度中等,是对知识的综合运用,理解实验原理是解题的关键,需要学生具有扎实的基础与综合运用分析解决问题的能力,注意题中信息PCl3遇O2会生成POCl3,POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点为解答关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 2-甲基-2-丁烯 | B. | 2-丁炔 | ||
| C. | 2-甲基-1,3-丁二烯 | D. | 1,3-丁二炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离产生的c(OH-)=10-12mol•L-1 | |
| B. | 向溶液中加入等体积的pH=2盐酸后溶液呈酸性 | |
| C. | 向溶液中加入稀盐酸可以促进氨水的电离,溶液的碱性增强 | |
| D. | 向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
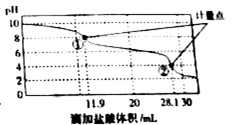 称取Na2CO3和NaHCO3混合物样品1.6226g,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol•L-1 盐酸滴定,得到如图曲线.以下说法错误的是( )
称取Na2CO3和NaHCO3混合物样品1.6226g,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol•L-1 盐酸滴定,得到如图曲线.以下说法错误的是( )| A. | 样品中Na2CO3含量越高,起始pH也越大 | |
| B. | 计量点①中有关离子浓度关系为:c(HCO3-)>C(Cl-)>c(CO32-) | |
| C. | 计量点②溶液中有关离子浓度关系为:2(CO32-)+c(HCO3-)=C(H+)-c(OH-) | |
| D. | 此样品n(NaHCO3)=(28.1-11.9)×10-3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.0 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 结论 |
| A | 乙烯分别通入酸性高锰酸钾和溴的四氯化碳溶 液,两溶液都褪色 | 这两个反应类型相同 |
| B | 油脂、多糖、蛋白质都能水解 | 三者都是天然高分子化合物 |
| C | 乙醇和乙酸都能和钠反应 | 两者的结构中都含有羟基 |
| D | 葡萄糖和乙醛都能和新制的氢氧化铜反应 | 两者的结构中都含有醛基 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA溶液的导电性比强酸弱 | |
| B. | 10 mL 1 mol/L的HA溶液与10 mL 1 mol/L的NaOH溶液恰好完全反应 | |
| C. | NaA溶液的pH>7 | |
| D. | 0.1 mol/L HA溶液的pH=1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com