
| t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| H2O | CO | CO2 | CO | |||
| A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| C | 1000 | 1 | 2 | c | d | t |
���� ��1�����ݻ�ѧ����ʽ��ƽ�ⳣ��������д�õ�����ʽ���ɱ������ݿ�֪�����¶�ƽ�ⳣ����С��˵������Ӧ���ȣ�ƽ�������ƶ������¶Ȳ��䣬��ƽ�ⳣ�����䣻
��2���ﵽ��ѧƽ��״̬�������Ũ�Ȳ��䣬���淴Ӧ��ȣ��Դ��жϣ�
��3����ʵ��B��ƽ��ʱCO2�����ʵ���Ϊ0.4mol����֪����0.4molH2O���ɼ���ƽ��ʱH2O ��g�������ʵ�����
���ɱ������ݿɼ���CO��ת���ʣ������ж�ת���ʵĴ�С��
��B��C��Ƚϣ�������ʼ���ʵ�����ͬ����C���¶Ƚϸߣ���Ӧ���ʽϴ�
��� �⣺��1����Ӧ�Ļ�ѧ����ʽΪCO��g��+H2O ��g��?CO2��g��+H2��g������K=$\frac{c��C{O}_{2}��•c��{H}_{2}��}{c��CO��•c��{H}_{2}O��}$���ɱ������ݿ�֪�����¶�ƽ�ⳣ����С��˵������Ӧ���ȣ�ƽ�������ƶ������¶Ȳ��䣬��ƽ�ⳣ�����䣬�罵�£���ƽ�ⳣ�����������ƶ���ƽ�ⳣ�������ܼ�С��ֻ�Т���ȷ��
�ʴ�Ϊ��K=$\frac{c��C{O}_{2}��•c��{H}_{2}��}{c��CO��•c��{H}_{2}O��}$�� ���ȣ��ۣ�
��2����a����Ӧǰ�������������䣬�����Ƿ�ﵽƽ��״̬��������ѹǿ�����䣬�����ж��Ƿ�ﵽƽ��״̬���ʴ���
��b�����������c��CO�����䣬��˵���ﵽƽ��״̬������ȷ��
��c��v����H2��=v����H2O����˵�����淴Ӧ������ȣ��ﵽƽ��״̬������ȷ��
��d��c��CO��=c��CO2��������˵���Ƿ�ﵽƽ��״̬���ʴ���
�ʴ�Ϊ��b c��
��3����ʵ��B��ƽ��ʱCO2�����ʵ���Ϊ0.4mol����֪����0.4molH2O���ɼ���ƽ��ʱH2O ��g�������ʵ���Ϊ1mol-0.4mol=0.6mol��
�ʴ�Ϊ��0.6mol��
��ʵ��A��CO��ת����Ϊ$\frac{4-2.4}{4}$=0.8��ʵ��B��CO��ת����Ϊ$\frac{2-1.6}{2}$=0.2����A��ת���ʴ���B���ʴ�Ϊ�����ڣ�
��B��C��Ƚϣ�������ʼ���ʵ�����ͬ����C���¶Ƚϸߣ���Ӧ���ʽϴ���C�õ�ʱ���С���ʴ�Ϊ��С�ڣ�
���� ���⿼�黯ѧƽ�������Ӱ�����ء���ѧƽ��״̬�жϡ���Ӧ�����жϵȣ�Ϊ��Ƶ����ͳ������ͣ����ؿ���ѧ����ʵ�����ݵķ���������������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
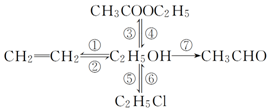 д�����и������ת���Ļ�ѧ����ʽ����˵�������ķ�Ӧ���ͣ�
д�����и������ת���Ļ�ѧ����ʽ����˵�������ķ�Ӧ���ͣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| H2O | CO | CO2 | H2 | |
| �� n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
| �� n/mol | 0.20 | 0.20 | 0 | 0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �� | B�� | �ڢ� | C�� | �٢� | D�� | �ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڱ����Ȼ�����Һ�еμ�NaOH��Һ���������ɫ���� | |
| B�� | ˮ�೧��ұ���ø�ѹֱ�����ȥ�����̳������ٶԿ�������Ⱦ | |
| C�� | �峿����ï�ܵ������У��������Կ���֦Ҷ������һ�������� | |
| D�� | ������˥�ߵȼ��������ѪҺ�ж���������ѪҺ���������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com