
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
分析 (1)①根据化学平衡的标志来判断;
②先根据反应 NH2COONH4(s)?2NH3(g)+CO2(g),可知平衡时容器内气体的浓度之比为2:1,由总浓度求出NH3、CO2 的平衡浓度,最后代入平衡常数的表达式来计算;
③根据压强对化学平衡移动的影响来回答;
④氨基甲酸铵分解反应是吸热反应;
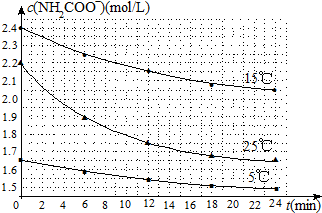
(2)⑤根据化学反应速率的公式来计算;
⑥由图象数据可以得出,用不同初始浓度,不同温度下的平均速率的大小来说明.
解答 解:(1)①A、因未指明速率的方向,无法确定正逆反应速率的关系,故A错误;
B、该反应是气体体积增大的反应,故当容器内压强不变时,已达到平衡,故B正确;
C、该反应是气体体积增大的反应,故当密闭容器中混合气体的密度不变,已达到平衡,故C正确;
D、因反应物(NH2COONH4)是固体物质,所以密闭容器中NH3的体积分数始终不变,为$\frac{2}{3}$.故D错误;
故答案为:BC;
②容器内气体的浓度之比为2:1,故NH3和CO2的浓度分别为3.2×10-3 mol/L、1.6×10-3 mol/L,代入平衡常数表达式:K=(3.2×10-3 )2×1.6×10-3 =1.6×10-8,
故答案为:1.6×10-8;
③若在恒温下压缩容器体积,则压强增大,平衡逆向移动,所以固体质量会增加,
故答案为:增加;
④氨基甲酸铵分解反应是吸热反应,反应焓变大于0,△H>0,
故答案为:>;
(2)⑤化学反应速率V=$\frac{△c}{△t}$=$\frac{2.2mol/L-1.9mol/L}{6min}$=0.05mol/(L•min),故答案为:0.05mol/(L•min);
⑥因25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大,
故答案为:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
点评 本题考查较为综合,涉及化学平衡状态的判断、平衡常数的计算,反应速率的计算等,为高频考点,侧重于学生的分析能力和计算能力的考查,题目注重了基础知识的考查,本题难度较大.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 可用物质的量表示分子、原子、离子、米粒等微粒或小颗粒物质 | |
| B. | 摩尔是国际单位制中的七个基本物理量之一 | |
| C. | 1mol任何物质都含有 6.02×1023个原子 | |
| D. | 0.012Kg12C所含碳原子数为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.9kJ/mol | B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-241.8kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=+285.9kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=+241.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
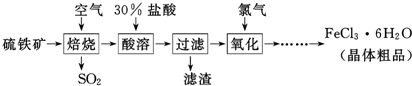
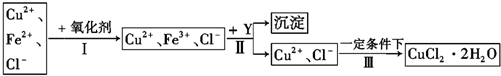
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
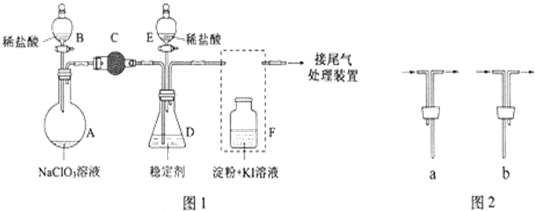
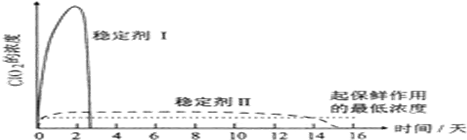
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 假 设 | 操 作 | 现 象 | 原 理 |
| Na2S2O4为强碱弱酸盐,其溶液为碱性. | 取少量溶液于试管中,滴加 ②紫色石蕊试液 | 溶液变成蓝色 | S2O42-水解,使溶液成碱性 |
| ①Na2S2O4具有还原性 | 取少量溶液于试管中,滴加过量新制氯水,再滴加 BaCl2 溶液 | 有白色沉淀生成 | 该反应的离子方程式依次为:③4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+,④Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
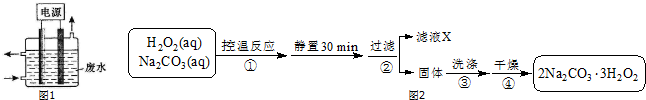
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
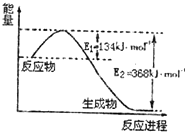 氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.
氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.| t/℃ | 25 | 125 | 225 | … |
| K/(mol•L-1)-2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com