
【题目】合成气(CO+H2)广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气。
(1)在150℃时2L的密闭容器中,将2molCH4和2molH2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=__。
②在该温度下,计算该反应的平衡常数K=__。
③下列选项中能表示该反应已达到平衡状态的是__。
A.v(H2)逆=3v(CO)正
B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变
D.C(CH4)=C(CO)
(2)合成气制甲醚的反应方程式为2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) △H=bkJ/mol。有研究者在催化剂(Cu—Zn—Al—O和A12O3)、压强为5.OMPa的条件下,由H2和CO直接制备甲醚,结果如图所示。
CH3OCH3(g)+H2O(g) △H=bkJ/mol。有研究者在催化剂(Cu—Zn—Al—O和A12O3)、压强为5.OMPa的条件下,由H2和CO直接制备甲醚,结果如图所示。
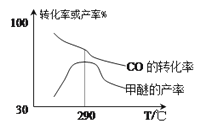
①290℃前,CO转化率和甲醚产率的变化趋势不一致的原因是__;
②b__0,(填“>”或“<”或“=”)理由是__。
(3)合成气中的氢气也用于合成氨气:N2+3H2![]() 2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是__;
2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是__;
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.ν乙>ν丙>ν甲 D.P乙>P甲=P丙
容器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2的 体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | ν甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1mol | φ乙 | ν乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2mol | φ丙 | ν丙 | P丙 |
【答案】0.12mol·L-1·min-1 21.87 AC 有副反应发生 < 平衡后,升高温度,产率降低 BD
【解析】
(1)
①v(H2)=![]() =0.12mol·L-1·min-1;
=0.12mol·L-1·min-1;
②K=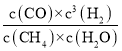 =
=![]() =21.87mol2L-2;
=21.87mol2L-2;
③A.v逆(H2)=3v正(CO),根据反应速率之比等于化学计量数之比有v正(H2)=3v正(CO),故v逆(H2)=v正(H2),反应已达到平衡状态,选项A选;
B.参与反应的物质均为气体,气体的总质量不变,反应在恒容条件下进行,故密度始终保持不变,密闭容器中混合气体的密度不变,不能说明反应已达到平衡状态,选项B不选;
C.同温同压下,气体的压强与气体的物质的量成正比,该反应正反应为气体体积增大的反应,密闭容器中总压强不变,则总物质的量不变,说明反应已达到平衡状态,选项C选;
D.反应开始时加入2 mol CH4和2 mol H2O(g),反应过程中两者的物质的量始终保持相等,c(CH4)=c(CO)不能说明反应已达到平衡状态,选项D不选。
答案选AC;
(4)① 290℃前,CO转化率随温度升高而降低,根据反应2CO(g) + 4H2(g)![]() CH3OCH3(g)+ H2O(g)可知甲醚是生成物,产率应该降低,但反而增大,证明还有另外的反应生成甲醚,即CO的转化率和甲醚产率的变化趋势不一致的原因是有副反应发生;
CH3OCH3(g)+ H2O(g)可知甲醚是生成物,产率应该降低,但反而增大,证明还有另外的反应生成甲醚,即CO的转化率和甲醚产率的变化趋势不一致的原因是有副反应发生;
②根据图中信息可知,平衡后,升高温度,产率降低,平衡向逆反应方向移动,逆反应为吸热反应,则正反应为放热反应,△H=b<0。
(3)根据表中数据知,甲丙中各反应物的浓度相等,所以相当于等效平衡,平衡时N2的体积分数相等;乙中各反应物浓度是甲的2倍,且压强大于甲,增大压强,平衡向气体体积缩小的方向移动,所以平衡时乙中N2的体积分数小于甲;
A.甲丙中各反应物的浓度相等,n2=3.2,乙压强大于甲乙,平衡正向移动,n1>3.2,选项A错误;
B.甲丙为等效平衡,平衡时N2的体积分数相等φ甲 =φ丙,乙压强大,平衡正向移动,平衡时乙中N2的体积分数小于甲,故φ甲 =φ丙>φ乙,选项B正确;
C.甲丙中各反应物的浓度相等,为等效平衡,反应速率相等,ν丙=ν甲,乙中各反应物浓度平衡时接近甲丙的二倍,反应速率较大,ν乙>ν丙=ν甲,选项C错误;
D.体积相同的容器中,甲丙等效,单位体积气体总物质的量浓度相同,压强相等P甲 =P丙,乙中平衡时单位体积气体总物质的量接近甲丙的二倍,P乙>P甲 =P丙,选项D正确。
答案选BD。


科目:高中化学 来源: 题型:
【题目】下图所示转化关系中A、B、C均为双原子气态单质,分别由短周期主族元素X、Y、Z组成。其中单质B含共用电子对数最多,甲和丙分子中均含有10个电子。下列说法错误的是
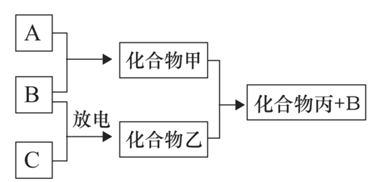
A.Z元素位于第二周期第VIA族
B.可用排水法收集化合物乙
C.常温下,pH=12的化合物甲的水溶液中,水电离出的c(H+)=10-12mol·L-1
D.化合物甲溶于化合物丙中,存在的微粒有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸,且具有还原性。
Ⅰ.20℃时,改变0.1mol·L-1H2C2O4溶液的pH,溶液中的H2C2O4、HC2O4—、C2O42—的物质的量分数δ(X)随pH的变化如图所示。
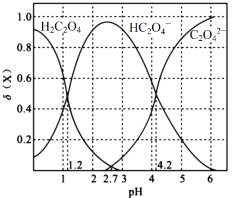
已知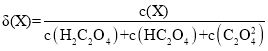
(1)Ka1(H2C2O4)=___________。
(2)0.1mol·L-1NaHC2O4溶液中离子浓度由大到小的顺序是___________。
(3)已知20℃时K(HCOOH)=1.77×10-4,向HCOONa溶液中加入少量H2C2O4,反应的离子方程式是___________。
Ⅱ.KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中的某些少量还原性物质还原,因此使用前须用H2C2O4·2H2O配制的标准溶液标定(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)。
(4)准确量取一定体积的KMnO4溶液需要使用的仪器是____________。
(5)某学生根据3次实验分别记录有关数据如表所示,该KMnO4溶液的物质的量浓度为___________mol·L-1。
实验序号 | 消耗0.1000mol·L-1的H2C2O4溶液的体积/mL | 待测KMnO4溶液的体积/mL |
1 | 29.90 | 25.00 |
2 | 30.00 | 25.00 |
3 | 30.10 | 25.00 |
(6)在上述滴定过程中,下述操作可导致被测定的KMnO4浓度偏高的是___________
a.未用标准液润洗滴定管
b.达到滴定终点,读数时俯视液面
c.盛装待测液的锥形瓶用蒸馏水洗过,未润洗
d.滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系如图所示.则甲和X不可能是( )

A. 甲为C,X为O2 B. 甲为SO2,X为NaOH溶液
C. 甲为Fe,X为Cl2 D. 甲为AlCl3,X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质之间有如下转化关系:
甲![]() 乙
乙![]() 丙
丙![]() 甲
甲
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是_________(写化学式,下同)。写出“乙![]() 丙”转化的离子方程式:______________________。
丙”转化的离子方程式:______________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲物质是__________。写出“甲![]() 乙”转化的离子方程式:_________________。
乙”转化的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示,提示:SiO2不与HCl反应。
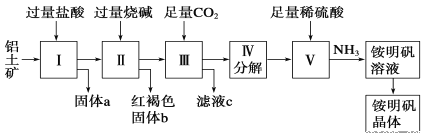
请回答下列问题:
(1)固体a的化学式为___。
(2)由图中Ⅱ所发生的离子方程式为___、___、___。Ⅲ所发生的离子方程式为___。
(3)从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)__、冷却结晶、过滤洗涤。
(4)以1000kg含氧化铝34%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数为98%的硫酸(密度1.84g·cm-3)__L(保留一位小数)。
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,0.1mol/L 的CH3COOH 溶液中有1% CH3COOH 分子发生电离,则溶液的pH=______________;可以使0.10mol·L-1 CH3COOH的电离程度增大的是____________。、
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1. d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH 均等于3 的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液有锌粉剩余,则生成氢气的体积:V( 盐酸)________V(醋酸)(填“>”、“ <” 或“=”)。
(3)0.1mol/L 的某酸H2A 的pH=4,则H2A 的电离方程式为_________________。
(4)某温度下,Kw=1×10-12,将0.02mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混和液的pH=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源。科学家探究太阳能制氢技术,设计流程图如图:
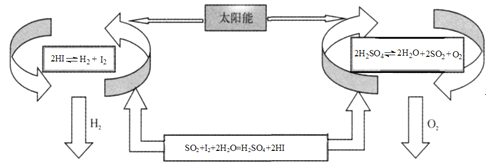
信息提示:以下反应均在150℃发生
2HI(aq)H2(g)+I2(g) △H1
SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g) △H2
2H2SO4(l)2H2O(g)+2SO2(g)+O2(g) △H3
2H2O(g)=2H2(g)+O2(g) △H4
请回答下列问题:
(1)△H4与△H1、△H2、△H3之间的关系是:△H4= ______ 。
(2)该制氢气技术的优点是 ______ ,若反应SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g)在150℃下能自发进行,则△H ______ 0(填“>”,“<”或“=”)。
(3)在某温度下,H2SO4在不同催化剂条件下分解产生氧气的量随时间变化如图所示,则下列说法正确的是 ______。
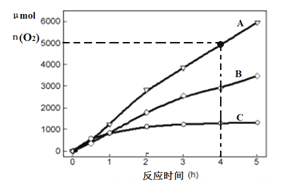
A H2SO4分解反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B 若在恒容绝热的密闭容器中发生反应,当K值不变时,说明该反应已经达到平衡
C 0~4小时在A催化剂作用下,H2SO4分解的平均速率v(O2)=1250molh-1
D 不同催化剂的催化效果不同,是因为活化分子百分数不相同
(4)对于反应:2HI(g)H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数 K的计算式为: ______ 。
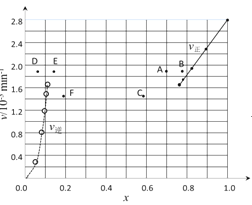
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为 ______ (以K和k正表示)。若k正=0.0027min-1,在t=40min时,v正= ______ min-1。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为 ______ (填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种绿色氧化剂,具有高效的杀菌消毒作用,常用于饮水处理,在许多领域展现出广阔的应用前景。制备高铁酸钾有下列两种方法:
方法一:Fe2O3 + KNO3 + KOH===== K2FeO4 + KNO2 + H2O (未配平)
方法二:2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+ 5H2O
(1)配平方法一的化学方程式___,再用双线桥标明电子转移的方向和数目___:
___Fe2O3 +___KNO3 +___KOH == ___ K2FeO4 +___ KNO2 +___ H2O
(2)方法二中的还原产物为_________ (写化学式),将方法二的化学方程式改写为离子方程式 ________ ,根据反应方程式,氧化性:KClO ________ K2FeO4(填“>”、“<”或“=”);
(3)利用方法二制备K2FeO4,若有0.5mol K2FeO4生成,转移的电子数为___________ ;
(4)在酸性溶液中,某反应的反应物和生成物有KBiO3、K2SO4、H2SO4、MnSO4、H2O、Bi2(SO4)3 和一种未知物质M。
①已知MnSO4在反应中失去电子,则该反应的氧化剂是________;
②已知该反应中被氧化的元素与被还原的元素的物质的量之比为2:5,则M的化学式为______;
③写出该反应的离子反应方程式________;
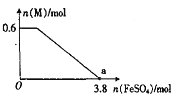
④某同学向上述反应后的溶液中逐滴加入FeSO4溶液,测得溶液中M的物质的量与FeSO4的物质的量之间的关系如图所示。已知氧化性:Fe3+>Bi3+,且a点时溶液中含Fe3+、Mn2+,则原反应体系中,起始加入的KBiO3的物质的量为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com