
【题目】如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:
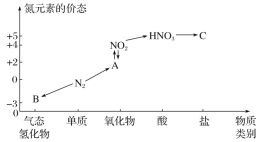
(1)写出 N2 的一种用途: ________________。
(2)B 物质的电子式为: ________________。
(3)HNO3与图中的物质 C 常用于检验 Cl-的存在,则 C 的化学式为______________。
(4)实验室制取物质 B 的化学方程式为 ______________。
(5)浓硝酸与木炭在加热条件下反应的化学方程式为 ___________。
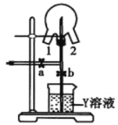
(6)如图装置可用于探究氯气与氨气的反应。实验时先通过三颈瓶瓶口 1 通入氨气,然后关闭 b 活塞,再通过瓶口 2 通入氯气。
①实验中三颈瓶内出现白烟并在内壁凝结成固体,发生反应的化学方程式为________,请设计一个实验方案鉴定该固体中的阳离子____________
② 实验完毕后,观察到三颈瓶内还有黄绿色气体, 简述如何处理才能不污染环境___________________。
(7)将 3.2g 铜与 60.0mL 一定浓度的硝酸发生反应,铜完全溶解,产生 NO2 和 NO 混合气体的体积为 8.96L(标况)。待产生的气体全部释放后,向溶液加入 100mL 2.0mol/L 的 NaOH 溶液,恰好使溶液中的 Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 _______________mol/L。
【答案】作保护气或作制冷剂或用于合成氨等(合理即可) ![]() AgNO3 2NH4Cl + Ca(OH)2
AgNO3 2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑ + 2H2O C + 4HNO3(浓)
CaCl2 + 2NH3↑ + 2H2O C + 4HNO3(浓) ![]() CO2↑ + 4NO2↑ + 2H2O 8NH3 + 3Cl2 = N2 + 6NH4Cl 取少量固体于试管中,加入NaOH溶液,微热,产生的气体在试管口用湿润的红色石蕊试纸检测,如果试纸变蓝,则证明该固体中含有NH4+ 将活塞b打开,Cl2即可被烧杯中的NaOH溶液吸收 10
CO2↑ + 4NO2↑ + 2H2O 8NH3 + 3Cl2 = N2 + 6NH4Cl 取少量固体于试管中,加入NaOH溶液,微热,产生的气体在试管口用湿润的红色石蕊试纸检测,如果试纸变蓝,则证明该固体中含有NH4+ 将活塞b打开,Cl2即可被烧杯中的NaOH溶液吸收 10
【解析】
(1)~(5)由图可判断,气态氢化物B为NH3,+2价氧化物为NO,C为硝酸盐。可在此基础上结合氮的单质及其化合物的结构和性质解(1)~(5)小题;
(6)氯气有强氧化性,能将氨气氧化,还原产物HCl与NH3 反应生成NH4Cl固体;检验该固体中的阳离子即为检验NH4Cl中的NH4+;
②三颈瓶内黄绿色气体为Cl2,Cl2能和碱反应,故可用碱溶液吸收;
(7)原硝酸溶液中的HNO3的物质的量等于未被还原的HNO3和被还原的HNO3的物质的量总和。未被还原的HNO3的物质的量等于反应后溶液中的NO3-的物质的量;根据N元素守恒,被还原的HNO3的物质的量等于还原产物NO2和 NO的物质的量总和。利用题给数据分别计算即可求得原硝酸溶液的浓度。
(1) N2 性质稳定,可作保护气;液氮温度低,可作制冷剂;N2 还可用于合成氨,等等。
答案为:作保护气或作制冷剂或用于合成氨等(合理即可);
(2) B 为NH3,为共价化合物,电子式为:![]() 。
。
答案为:![]() ;
;
(3) 检验 Cl- 常用HNO3酸化的AgNO3 溶液,所以C 的化学式为AgNO3。
答案为:AgNO3;
(4) 实验室常用NH4Cl和碱石灰共热制取 NH3,化学方程式为:2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑ + 2H2O。
CaCl2 + 2NH3↑ + 2H2O。
答案为:2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑ + 2H2O;
CaCl2 + 2NH3↑ + 2H2O;
(5) 浓硝酸与木炭在加热条件下反应的化学方程式为:C + 4HNO3(浓) ![]() CO2↑ + 4NO2↑ + 2H2O。
CO2↑ + 4NO2↑ + 2H2O。
答案为:C + 4HNO3(浓) ![]() CO2↑ + 4NO2↑ + 2H2O;
CO2↑ + 4NO2↑ + 2H2O;
(6) ① 在三颈瓶内,氯气将氨气氧化成氮气,还原产物HCl与NH3 反应生成NH4Cl固体,所以发生反应的化学方程式为:8NH3 + 3Cl2 = N2 + 6NH4Cl;NH4Cl中NH4+ 的检验方法为:取少量固体于试管中,加入NaOH溶液,微热,产生的气体在试管口用湿润的红色石蕊试纸检测,如果试纸变蓝,则证明该固体中含有NH4+。
答案为:8NH3 + 3Cl2 = N2 + 6NH4Cl;取少量固体与试管中,加入NaOH溶液,微热,产生的气体在试管口用湿润的红色石蕊试纸检测,如果试纸变蓝,则证明该固体中含有NH4+;
② 三颈瓶内黄绿色气体为Cl2,Cl2能和碱反应,故可用碱溶液(如NaOH溶液)吸收,可将活塞b打开,Cl2即可被烧杯中的NaOH溶液吸收。
答案为:将活塞b打开,Cl2即可被烧杯中的NaOH溶液吸收;
(7) 根据分析可知,原硝酸溶液中的HNO3 的物质的量等于反应后溶液中的NO3- (未被还原的HNO3)和还原产物NO2 和 NO的物质的量总和(被还原的HNO3)。一、反应后溶液中的的NO3- :向反应后溶液加入NaOH 溶液恰好使溶液中的 Cu2+ 全部转化成沉淀后,溶液的溶质为NaNO3,则有:n(NO3-)=n(Na+)=100×10-3L×2.0mol/L=0.2mol;二、被还原的HNO3:还原产物为NO2 和 NO,所以,被还原的HNO3的物质的量为:![]() ;则原硝酸溶液的浓度为:
;则原硝酸溶液的浓度为:![]() 。
。
答案为:10。


科目:高中化学 来源: 题型:
【题目】(1)砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有![]() ,其原因是____________。
,其原因是____________。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题图1和题图2所示。
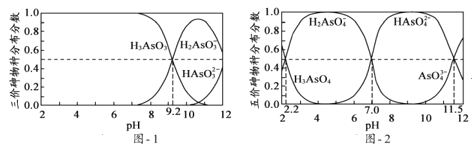
①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为____。
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4+H+的电离常数为Ka1,则pKa1=____(pKa1=-lgKa1)。
H2AsO4+H+的电离常数为Ka1,则pKa1=____(pKa1=-lgKa1)。
(3)25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是______。
A.0.1mol/L CH3COONa溶液与0.1mol/L HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.含等物质的量的NaX和弱酸HX的混合溶液中一定存在:c(Na+)>c(X-)
C.0.1mol/L Na2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
D.Na2C2O4溶液与HCl溶液等体积混合(H2C2O4是二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+)
(4)下列图示与对应的叙述不相符的是______。
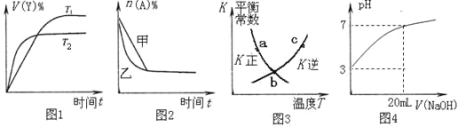
A.图1表示可逆反应“2X(g) ![]() Y(g)△H<0”温度T1<T2的情形
Y(g)△H<0”温度T1<T2的情形
B.图2表示压强对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响,乙压强比甲压强大
3C(g)+D(s)的影响,乙压强比甲压强大
C.图3中a、b、c三点中只有b点已经达到化学平衡状态
D.图4是向20 mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液过程中pH变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】历史上被称为“世界八大公害”和“20 世纪十大环境公害”之一的洛杉矶光化学烟雾事件使 人们深刻认识到了汽车尾气的危害性。汽车尾气中氮氧化物和碳氢化合物受紫外线作用可产 生二次污染物光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是( )
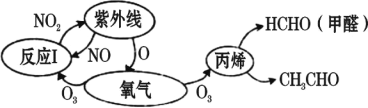
A.烟雾是一种固溶胶,其分散剂是空气B.O2 和 O3 是氧的两种同素异形体
C.反应 I 属于氧化还原反应D.NO2 不是酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列物质的结构简式:
(1)2,4-二氯甲苯的结构简式为____;
(2)反-2-戊烯的结构简式为___;
(3)分子式为C6H12的某烯烃与氢气加成后得到的烷烃分子中含4个甲基,且该烯烃不存在顺反异构体,则该烯烃的一种结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如下图所示。下列说法不正确的是( )

A. 曲线Ⅰ代表盐酸的稀释过程 B. a溶液的导电性比c溶液的导电性强
C. a溶液中和氢氧化钠的能力强于b溶液 D. 将a、b两溶液加热至30℃, 变小
变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用![]() 的盐酸滴定
的盐酸滴定![]() 溶液
溶液![]() 。用 pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是
。用 pH传感器测得混合溶液的pH变化曲线如图,下列说法正确的是
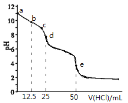
A.![]() 发生的主要离子反应:
发生的主要离子反应:![]()
B.在b点时,![]()
C.在d点时,![]()
D.在e点时![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.浓度均为0.1mol/L的①NH4Fe(SO4)2;②NH4HSO4;③(NH4)2CO3;④CH3COONH4溶液中c(NH4+)的大小顺序为③>①>②>④
B.浓度均为0.1mol/L的CH3COONa溶液与NaClO溶液,溶液中阴、阳离子的总浓度前者大于后者
C.H3PO2为一元弱酸,在NaH2PO2水溶液中存在:c(H3PO2)+c(H2PO2-)=c(Na+)
D.0.1mol/L的Ca(HCO3)2溶液中:c(HCO3-)+c(H2CO3)+c(CO32-)=0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH是溶液中![]() 的负对数,若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,某浓度的草酸
的负对数,若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,某浓度的草酸![]() 水溶液中
水溶液中![]() ,
,![]() 、
、![]() 随着溶液pH的变化曲线如图所示。下列说法 不 正 确的是
随着溶液pH的变化曲线如图所示。下列说法 不 正 确的是

A.曲线Ⅰ代表![]() 的浓度随着pH增大先变小后变大
的浓度随着pH增大先变小后变大
B.草酸的电离常数![]() ;
;![]()
C.![]() 时,
时,![]()
D.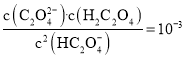
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.滴加酚酞的氨水中加入氯化铵固体后红色变浅
C.煅烧粉粹的硫铁矿有利于SO2的生成
D.黄绿色的氯水光照后颜色变浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com