
【题目】镇痛药物![]() 的合成方法如下:
的合成方法如下:

已知:
(1)![]() 的名称为_________________;②的反应类型为_________________反应。
的名称为_________________;②的反应类型为_________________反应。
(2)![]() 的结构简式为_________________.
的结构简式为_________________.![]() 中含氧官能团的名称为_________________.
中含氧官能团的名称为_________________.
(3)③的化学方程式为__________________________________。
(4)有机物![]() 分子组成比
分子组成比![]() 少两个氢原子,符合下列要求的
少两个氢原子,符合下列要求的![]() 的同分异构体有_________种。
的同分异构体有_________种。
A 遇![]() 显紫色 B 苯环上有两个取代基
显紫色 B 苯环上有两个取代基
(5)已知④有一定的反应限度,反应进行时加入吡啶(![]() ,属于有机碱)能提高
,属于有机碱)能提高![]() 的产率,原因是___________________________________________________。
的产率,原因是___________________________________________________。
(6) ,是一种重要的化工中间体。以环己醇(
,是一种重要的化工中间体。以环己醇(![]() )和乙醇为起始原料,结合己知信息选择必要的无机试剂,写出
)和乙醇为起始原料,结合己知信息选择必要的无机试剂,写出 的合成路线。
的合成路线。
(已知:![]()
![]() 、
、![]() 为烃基。用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________________________________
为烃基。用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________________________________
【答案】3-氯丙烯(或3-氯-1-丙烯) 取代反应 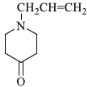 羰基
羰基 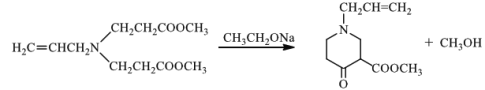 15 吡啶显碱性,能与反应④的产物HCl发生中和反应,使平衡正向移动,提高J产率
15 吡啶显碱性,能与反应④的产物HCl发生中和反应,使平衡正向移动,提高J产率 
【解析】
由![]() 逆推,可知B是
逆推,可知B是![]() 、A是
、A是![]() ;
;
![]() ,结合
,结合![]() ,可知C是
,可知C是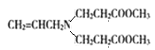 ;由
;由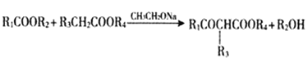 ,
,![]() ,则D是
,则D是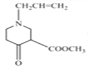 ,D在稀硫酸中水解为E
,D在稀硫酸中水解为E ;根据
;根据 ,逆推F为
,逆推F为![]() 。
。
根据上述分析可知,
(1)有机物A为CH2=CH-CH3,与氯气在500℃发生取代反应生成CH2=CH-CH2Cl(B),其名称为3-氯丙烯(或3-氯-1-丙烯);结合给定信息可知②的反应类型为取代反应,
故答案为:3-氯丙烯(或3-氯-1-丙烯);取代反应;
(2)对照有机物E结构简式,结合有机物F的分子式可知,有机物E→F脱去二氧化碳,去掉COO,得到F结构简式为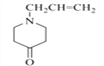 ;依据官能团的结构特点可知,F中含氧官能团名称为羰基;
;依据官能团的结构特点可知,F中含氧官能团名称为羰基;
故答案为: 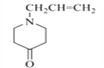 ;羰基;
;羰基;
(3)根据题给信息可知:有机物C在乙醇钠条件下,发生反应生成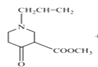 ;所以③化学方程式为
;所以③化学方程式为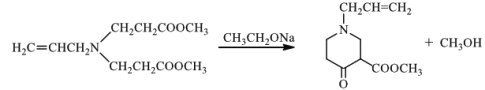 ;
;
故答案为: 。
。
(4)有机物F为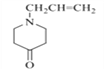 ,有机物K分组成比F少两个氢原子,分子式为C8H11NO,a.遇FeCl3显紫色,含有酚羟基;b.苯环上有两个取代基,一个必须是酚羟基;具体结构如下:苯环上分别连有-OH 和-CH2CH2-NH2 结构有3种;苯环上分别连有-OH 和 CH3CH(NH2)-结构有3种;苯环上分别连有-OH 和CH3-NH-CH2-结构有3种;苯环上分别连有-OH 和CH3CH2NH- 结构有3种;苯环上分别连有-OH 和(CH3)2N- 结构有3种;共计有15种;
,有机物K分组成比F少两个氢原子,分子式为C8H11NO,a.遇FeCl3显紫色,含有酚羟基;b.苯环上有两个取代基,一个必须是酚羟基;具体结构如下:苯环上分别连有-OH 和-CH2CH2-NH2 结构有3种;苯环上分别连有-OH 和 CH3CH(NH2)-结构有3种;苯环上分别连有-OH 和CH3-NH-CH2-结构有3种;苯环上分别连有-OH 和CH3CH2NH- 结构有3种;苯环上分别连有-OH 和(CH3)2N- 结构有3种;共计有15种;
故答案为:15;
(5) 吡啶(C5H5N,属于有机碱),吡啶显碱性,能与反应④的产物HCl发生中和反应,使平衡正向移动,提高J产率;
故答案为:吡啶显碱性,能与反应④的产物HCl发生中和反应,使平衡正向移动,提高J产率;
(6) ![]() 发生消去生成环己烯,环己烯酸性被高锰酸钾溶液氧化为HOOC-CH2-CH2-CH2-CH2-COOH,该有机物再与乙醇发生酯化反应生成CH3CH2OOC-CH2-CH2-CH2-CH2-COOCH2CH3,最后根据信息
发生消去生成环己烯,环己烯酸性被高锰酸钾溶液氧化为HOOC-CH2-CH2-CH2-CH2-COOH,该有机物再与乙醇发生酯化反应生成CH3CH2OOC-CH2-CH2-CH2-CH2-COOCH2CH3,最后根据信息 ,CH3CH2OOC-CH2-CH2-CH2-CH2-COOCH2CH3在乙醇钠的条件下发生反应生成
,CH3CH2OOC-CH2-CH2-CH2-CH2-COOCH2CH3在乙醇钠的条件下发生反应生成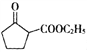 ;合成流程如下:
;合成流程如下: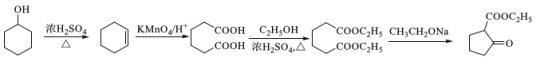 ;正确答案:
;正确答案: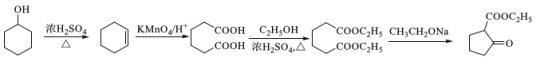 。
。


科目:高中化学 来源: 题型:
【题目】工业上生产氮化硅陶瓷反应为3SiCl4+2N2+6H2![]() Si3N4+12HCl,有关该反应说法正确的是
Si3N4+12HCl,有关该反应说法正确的是
A. SiCl4是氧化剂 B. N2发生还原反应
C. H2被还原 D. N2失电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化合物的治理是环保的一项重要工作,合理应用和处理氮的化合物,在生产生活中有着重要的意义。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+181.5 kJ·mol-1某科研小组尝试利用固体表面催化工艺进行NO的分解。若用●● 、●○ 、○○和![]() 分别表示N2 、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如下图所示。从吸附到解吸的过程中,能量状态最低的是___________(填字母序号)。
分别表示N2 、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如下图所示。从吸附到解吸的过程中,能量状态最低的是___________(填字母序号)。

(2)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
②CH4(g)+4NO(g)=2N2 (g)+CO2 (g)+2H2O(g) △H2=-1160 kJ/mol
③CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3
则△H3=___________。
(3)亚硝酰氯(ClNO)是有机合成中常用试剂,已知:2NO(g)+Cl2(g)![]() 2 ClNO(g) △H<0
2 ClNO(g) △H<0
①一定温度下,将2 molNO与2 molCl2置于2L密闭容器中发生反应,若该反应4min后达平衡,此时压强是初始的0.8倍,则平均反应速率v(Cl2)=___________mol·L-1·min-1。下列可判断反应达平衡状态的是___________(项序号字母)。
A 混合气体的平均相对分子质量不变
B 混合气体密度保持不变
C NO和Cl2的物质的量之比保持不变
D 每消耗1 moI NO同时生成1molClNO
②为了加快化学反应速率,同时提高NO的转化率,其他条件不变时,可采取的措施有___________(填选项序号字母)。
A 升高温度 B 缩小容器体积
C 再充入Cl2气体 D 使用合适的催化剂
③一定条件下在恒温恒容的密闭容器中,按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图(b)所示,当n(NO)/n(Cl2)=2.5时,达到平衡状态,ClNO的体积分数可能是图中D、E、F三点中的___________点。

(4)已知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快),v1正=k1正c2(NO),v1逆 =k1逆c (N2O2)
N2O2(g)(快),v1正=k1正c2(NO),v1逆 =k1逆c (N2O2)
②N2O2(g)+O2(g)![]() 2NO2(g)(慢),v2正=k2正c(N2O2)·c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢),v2正=k2正c(N2O2)·c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小:E1___________E2(填“>”、"<”或“=”):2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为___________。
2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅是人类较早发现和使用的一种重金属,工业上用铅精矿(主要成分含PbS)为原料,分火法和湿法两种方法冶炼。
Ⅰ.火法冶炼粗铅的流程如下:

(1)焙烧炉中主要反应的化学方程式为______________________。
(2)鼓风炉中焦炭的作用是___________,吸收塔中反应的离子方程式为___________。
Ⅱ.湿法炼铅的工艺流程如下:

已知:①不同温度下PbCl2的溶解度如下表所示。

②PbCl2为能溶于水的弱电解质,在含Cl-的溶液中存在平衡:
PbCl2(aq)+2Cl-(aq)![]() PbCl42-(aq)。
PbCl42-(aq)。
(3)浸取过程中发生反应的离子方程式为______________________。
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,其合理的解释为___________。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。则阴极室中的电极反应式为___________;若该电解装置的外接电源为铅蓄电池,每生成20.7g铅,铅蓄电池中消耗硫酸的物质的量为___________。

(6)目前炼铅工艺以火法为主,但湿法炼铅也有其明显的优点,其优点是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、火力发电厂释放出大量氮氧化合物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H1=-574 kJ/mol
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H2=-1160 kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为__________________________。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
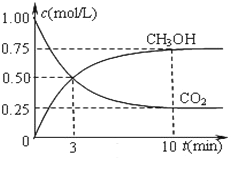
在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行反应。测得CO2和CH3OH(g)浓度随时间变化如图所示。回答:0~10 min内,氢气的平均反应速率为___mol/(L·S);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡_________(填“正向”、“逆向”或“不”)移动。
Ⅱ、如下图所示C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。
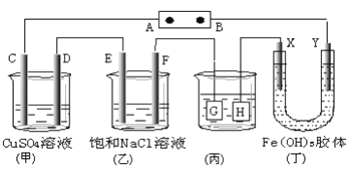
(1)若用甲醇、空气燃料电池作电源,电解质为KOH溶液,则A极的电极反应式为_________________________
(2)欲用(丙)装置给铜镀银,银应该是 _____电极(填G或H)
(3)(丁)装置中Y极附近红褐色变_______(填深或浅)
(4)通电一段时间后,C、D、E、F电极均有单质生成,其物质的量之比为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,可用离子方程式![]() +
+![]() =
=![]() 表示的是
表示的是
A.NH4Cl+NaOH![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
B.Mg(OH)2+2HCl=MgCl2+2H2O
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别用0.1 mol·L-1溶液进行下列实验,结论不正确的是
A. 向NaHCO3溶液中通CO2至pH=7:c(Na+) = c(HCO3-) +2c(CO32-)
B. 向CH3COONa溶液中加入等浓度等体积的盐酸:c(Na+)=c(Cl![]() )
)
C. 向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH=13
D. 向氨水中加入少量NH4Cl固体:![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为:
C. NCl3分子是非极性分子
D. NBr3比NCl3易挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=__________kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=_________kJ·mol-1
(2)反应①的化学平衡常数K的表达式为_______________;③的化学平衡常数K的表达式为_____________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com