
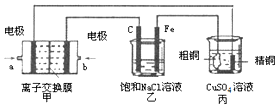
分析 (1)电解饱和食盐水时,酚酞变红的极是阴极,阴极和电源负极相连,则在Fe极附近显红色,所以Fe是阴极,据此确定其他电极名称;
(2)C为阳极,阳极上氯离子失电子生成氯气;电解饱和氯化钠溶液生成氯气、氢气和氢氧化钠溶液;
(3)乙装置中精铜电极的质量增加了6.4g,根据电极反应:Cu2++2e-=Cu,即生成6.4g即0.1mol铜,转移电子是0.2mol,根据电子守恒计算消耗的甲烷和生成的氢气.
解答 解:电解饱和食盐水时,酚酞变红的极是阴极,阴极和电源负极相连,则在Fe极附近显红色,所以Fe是阴极,C为阳极,a是负极、b是正极,粗铜是阳极,精铜是阴极
(1)(甲)装置是甲烷燃料电池(电解质溶液为KOH溶液),a是负极、b是正极,则b处通入的是氧气,a极通入的是甲烷,a处电极上发生的电极反应式为CH4+10OH--8e-=CO32-+7H2O;
故答案为:O2;CH4+10OH--8e-=CO32-+7H2O;
(2)C为阳极,阳极上氯离子失电子生成氯气,发生氧化反应;电解饱和氯化钠溶液生成氯气、氢气和氢氧化钠溶液,电极离子方程式为:;
故答案为:氧化;2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑;
(3)乙装置中精铜电极的质量增加了6.4g,根据电极反应:Cu2++2e-=Cu,即生成6.4g即0.1mol铜,转移电子是0.2mol,铁电极是阴极,该极上产生氢气,2H++2e-=H2↑,当转移0.2mol电子时,该极上产生的气体为0.1mol,在标准状况下体积为2.24L,甲烷失去电子,电极反应为CH4-8e-+10OH-=CO32-+7H2O,消耗的 CH4的物质的量为$\frac{0.2mol}{8}$=0.025mol,质量为0.025mol×16g/mol=0.4g;
故答案为:0.4g;2.24L.
点评 本题考查原电池和电解原理,明确电池反应中元素的化合价变化、发生的反应是解答的关键,注意放电顺序的应用及电子守恒,题目难度中等,侧重于考查学生的分析能力和计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
| 实验序号 | H2C2O4溶液 | KMnO4溶液 | 温度 |
| Ⅰ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅱ | 20mL 0.1mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅲ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 50℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | 金属质量 g | 金属状态 | c(H2SO4) mol•L-1 | V(H2SO4) mL | 溶液温度/℃ | 金属消失的 时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.64 | 0.50 | 0.50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com