
����Ŀ�����ݻ�������ܱ������д������·�Ӧ��2SO2��g��+O2��g��2SO3��g����H=��Q kJmol��1��Q��0����ij�о�С���о���������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ���ǣ�������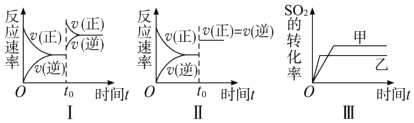
A.ͼ���о�����t0ʱ������O2��Ũ�ȶԷ�Ӧ���ʵ�Ӱ��
B.ͼ���о������¶ȶԻ�ѧƽ���Ӱ�죬���ҵ��¶Ƚϵ�
C.ͼ���о����Ǵ�����ƽ���Ӱ�죬�ҼĴ�Ч�ʱ��Ҹ�
D.ͼ���о�����t0ʱ�̼��������Է�Ӧ���ʵ�Ӱ��
���𰸡�D
��������A��I��t0ʱ�����淴Ӧ���ʾ���ԭƽ��ʱ��������Ӧ���ʴ����淴Ӧ���ʣ��ı�����ӦΪ����ѹǿ����A���������⣻
B���÷�ӦΪ���ȷ�Ӧ���¶�����ƽ�������ƶ�����Ӧת���ʼ�С����ͼ���о������¶ȶԻ�ѧƽ���Ӱ�죬���ҵ��¶Ƚϸߣ���B���������⣻
C��������ƽ���ƶ���Ӱ�죬ͼ��ת���ʷ����仯����ͼ���о������¶ȶԻ�ѧƽ���Ӱ�죬��C���������⣻
D��ͼ�������淴Ӧ����ͬ�ȳ̶ȵ������Ҹ÷�ӦΪ����������ȵķ�Ӧ����ͼ���о�����t0ʱ�̼��������Է�Ӧ���ʵ�Ӱ�죬��D�������⣻
���Դ��ǣ�D��
�����㾫�������ڱ��⿼��Ļ�ѧƽ��״̬���ʼ���������Ҫ�˽⻯ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч�����ܵó���ȷ�𰸣�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ��ܽ�����������������һ����ɣ�˵���塢�ⵥ�������Ȼ�̼�б���ˮ���ܽ�ȴ�����˵����ȷ����(����)
A. �塢�ⵥ�ʺ����Ȼ�̼�ж�����±��
B. �塢���ǵ��ʣ����Ȼ�̼�ǻ�����
C. Cl2��Br2��I2�ǷǼ��Է��ӣ�CCl4Ҳ�ǷǼ��Է��ӣ���ˮ�Ǽ��Է���
D. ����˵��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3��H2S���Ǽ��Է��ӣ�CO2��BF3��CCl4���Ǻ����Լ��ķǼ��Է��ӡ���������ʵ�����Ƴ�ABn�ͷ����ǷǼ��Է��ӵľ��������(����)
A. �����в��ܺ�����ԭ��
B. ��ABn������A�����ԭ������ӦС��B�����ԭ������
C. ��ABn������Aԭ��û�йµ��Ӷ�
D. ������ÿ�����ۼ��ļ���Ӧ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������뽺�������йص��ǣ� ��
A.���ô����ȥ��¯�е�ˮ��
B.������оʽ��ˮ�������û���̿��ˮ
C.�峿�������п��Կ���һ���ƹ���
D.���Ȼ�����Һ�еμ�����������Һ�������ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��еĢ١�����Ԫ�أ���д���пհף�
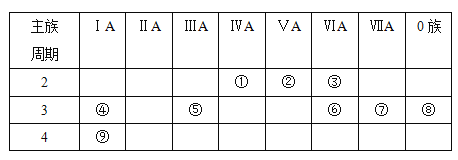
��1������ЩԪ���У���ѧ��������õ���________����Ԫ�ط��ţ���ͬ����
��2���Ӣٵ��۵�Ԫ���У��ǽ�������ǿ����________
��3��������������ˮ�����У�������ǿ�Ļ�����Ļ�ѧʽ��_______��������ǿ�Ļ�����ĵ���ʽ��_________��
��4������������������������Ԫ����_______��д������������������������Ʒ�Ӧ�����ӷ���ʽ_______________________________��
��5���ýṹʽ��ʾԪ�آ�����γɵ�һ�ֿ�����ˮ�Ļ�����_________ ��
��6��д��Ԫ�آܵĵ�����ˮ��Ӧ�Ļ�ѧ����ʽ________________________________��
��7��д��Ԫ�آٵĵ��ʺ�Ԫ�آ�����������Ӧˮ�����Ũ��Һ��Ӧ�Ļ�ѧ����ʽ___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���õ����裨Si3N4���մɴ���������췢���������Ȳ������ܴ������߷���������Ч�ʣ���ҵ���û�ѧ����������Ʊ������裬�䷴Ӧ���£�
3SiCl4��g��+2N2��g��+6H2��g��Si3N4��s��+12HCl��g����H��0 ���������գ�
��1����һ���¶��½���������Ӧ������Ӧ�������ݻ�Ϊ2L��3min��ﵽƽ�⣬��ù��������������2.80g����H2��ƽ����Ӧ���� mol��Lmin����1���÷�Ӧ��ƽ�ⳣ������ʽK= ��
��2��������Ӧ�ﵽƽ�������˵����ȷ���� ��
a�������������䣬ѹǿ����ƽ�ⳣ��K��С
b�������������䣬�¶����ߣ�ƽ�ⳣ��K��С
c�������������䣬����Si3N4���ʵ�����ƽ�������ƶ�
d�������������䣬����HCl���ʵ�����ƽ�������ƶ�
��3����0.050mol SO2��g����0.030mol O2��g�������ݻ�Ϊ1L���ܱ������У���Ӧ2SO2��g��+O2��g��2SO3��g����һ�������´ﵽƽ�⣬���c��SO3��=0.040mol/L������������·�Ӧ��ƽ�ⳣ��K��SO2��ƽ��ת���ʣ�д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ��ǿ������������������������ȡ�
��1��O3��KI��Һ��Ӧ���ɵ����ֵ�����___________��_________�������ʽ����
��2��O3��ˮ���ֽ⣬һ�������£�O3��Ũ�ȼ���һ�������ʱ�䣨t�������ʾ����֪��O3����ʼŨ��Ϊ0.0216 mol/L��
| 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
��pH�����ܼ���O3�ֽ⣬������O3�ֽ�������õ���___________.��
����30��C��pH=4.0�����£�O3�ķֽ�����Ϊ__________ mol/(L��min)��
�۾ݱ��еĵݱ���ɣ��Ʋ�O3�����������·ֽ��������������˳��Ϊ______.������ĸ���ţ�
a. 40��C��pH=3.0 b. 10��C��pH=4.0 c. 30��C��pH=7.0
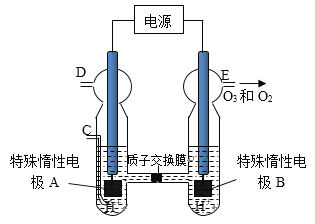
��3��O3 ���ɳ�����������ԭ����ͼ�����ϡ�����Ƶá�
��ͼ������Ϊ_________(�A����B��)����缫��ӦʽΪ_________________.
����C��ͨ��O 2 ����A���ĵ缫��ӦʽΪ_____________________.
����C����ͨ��O 2 ��D��E���ֱ��ռ���xL����yL����(��״��)����E���ռ���������O 3 ��ռ���������Ϊ__________.(����O 3 �ķֽ�)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ͬ�¶���ˮ��Һ��c(H��)��c(OH��)�Ĺ�ϵ�������ж���ȷ����( )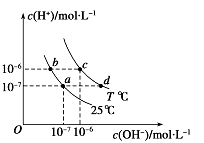
A.ֻ�������µķ�ʽ������a����d��
B.T��25
C.b���c��pH��Ϊ6����Һ������
D.������������������c (H��) ��c (OH��)��Kw
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com