
| A. | 肯定有 Al3+、Mg2+、HCO3- | B. | 肯定有 Al3+、Mg2+ | ||
| C. | 肯定没有HCO3-、MnO4-、NH4+、K+ | D. | 能确定K+、Cl-是否存在 |
分析 无色溶液中不含有色离子,则没有MnO4-;
①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解,则沉淀的成分是氢氧化镁和氢氧化铝;
②取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生,不溶于硝酸的白色沉淀是硫酸钡沉淀,以此解答该题.
解答 解:无色溶液中不含有色离子,则没有MnO4-;
①取部分溶液,加入适量Na2O2固体,过氧化钠先是和水反应生成氢氧化钠和氧气,产生无色无味的气体是氧气,一定不是氨气,故溶液中无NH4+,此时白色沉淀出现,再加入足量的NaOH溶液后白色沉淀部分溶解,则沉淀的成分是氢氧化镁和氢氧化铝,则证明其中一定含有A13+和Mg2+,一定不含有HCO3-(和Al3+不共存);
②取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生,和硫酸根离子反应生成白色不溶于硝酸的白色沉淀是硫酸钡沉淀,证明一定含有硫酸根离子;
综上可知肯定有A13+、Mg2+、SO42-,不能确定是否含有K+、Cl -,
故选B.
点评 本题考查了常见离子的检验,为高频考点,侧重考查学生的分析能力和实验能力,注意明确常见离子的性质及检验的方法,特别是熟悉具有特殊现象的离子,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 46g14CO2含有的中子数为22NA | |
| B. | 标准状况下,22.4LCH3C1含有的分子数为NA | |
| C. | lmol甲醇中含有C-H键的数目为4NA | |
| D. | 6.8g液态KHSO4中含有0.1NA个阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 含氯苯(
含氯苯( )的废水可通过加入适量乙酸钠,设计成微生物电池将氯苯转化为苯而除去,其除去原理如图所示,下列叙述正确的是( )
)的废水可通过加入适量乙酸钠,设计成微生物电池将氯苯转化为苯而除去,其除去原理如图所示,下列叙述正确的是( )| A. | A极为负极,发生氧化反应 | B. | H+由A极穿过质子交换膜到达B极 | ||
| C. | A 极电极反应式为 +2e-+H+=Cl-+ +2e-+H+=Cl-+ | D. | 反应后电解液的pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 利用铅蓄电池对如图装置进行供电,能模拟植物光合作用,将简单无机物转化为O2和C3H8O,下列说法不正确的是( )
利用铅蓄电池对如图装置进行供电,能模拟植物光合作用,将简单无机物转化为O2和C3H8O,下列说法不正确的是( )| A. | 该装置实现了将太阳能、电能转化为化学能 | |
| B. | b极上每生成0.1molO2,铅蓄电池的负极增重19.2g | |
| C. | a极上每生成0.1molC3H8O,有1.8mol电子发生转移 | |
| D. | 质子交换膜的作用是传导电子、平衡电荷,沟通回路 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I- |
| B | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中一定有SO42- |
| C | 向10mL 0.2mol/LNaOH溶液中先滴入2滴0.1mol/LMgCl2溶液,再滴加2滴0.1mol/LFeCl3溶液 | 先有白色沉淀生成,加入FeCl3溶液后,又有红褐色沉淀生成 | 在相同的温度下的Ksp:Mg(OH)2>Fe(OH)3 |
| D | 滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中一定无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂发生皂化反应能生成甘油 | |
| B. | 丙烷和2-甲基丙烷的一氯代物均为两种 | |
| C. | 酿酒过程中,葡萄糖可通过水解反应生成酒精 | |
| D. | 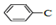 ≡C-COOH是高分子化合物 ≡C-COOH是高分子化合物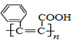 的单体 的单体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
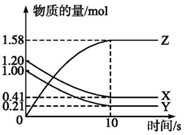 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H4=$\frac{1}{3}$(3△H3-△H1-△H2) | B. | △H4=$\frac{1}{3}$(△H1+△H2-3△H3) | ||
| C. | △H4=$\frac{3}{4}$(△H1+△H2-3△H3) | D. | △H4=$\frac{3}{4}$(△H1-△H2-3△H3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com