
A、NH
| ||||
B、K+、Na-、ClO-、SO
| ||||
| C、Fe3+、Na-、Cl-、SCN- | ||||
D、K+、Al3+、NO
|


科目:高中化学 来源: 题型:
| A、Fe(NO3)x中的x=2 |
| B、若反应中每0.2mol氧化剂被还原,则转移0.6mol电子 |
| C、稀HNO3在此反应中只表现氧化性 |
| D、磁性氧化铁中的铁元素全部被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
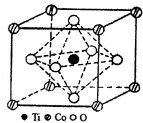 MnO2是碱锰电池材料中最普通的正极材料之一,在MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.
MnO2是碱锰电池材料中最普通的正极材料之一,在MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.| 元素 | Mn | Fe | |
| 电离能/kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ?mol-1) | 786 | 715 | 3 401 |


查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.75 | B、0.70 |
| C、0.64 | D、0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若V1>V2,则说明HA的酸性比HB的酸性弱 |
| B、因为两种酸溶液的pH相等,故V1一定等于V2 |
| C、若V1>V2,则说明HA的酸性比HB的酸性强 |
| D、因为两种酸溶液的pH相等,所以HA与HB的酸性相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol羟基中含有10NA个电子 |
| B、标准状况下,22.4 L氢气和氧气的混合气体,含有NA 个分子 |
| C、1 L 1 mol/L 的FeCl3溶液中含有NA 个Fe3+ |
| D、1 mol Cu和足量稀硝酸反应生成NO 气体,转移3NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com