
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )

A. 电池工作一段时间后,乙池溶液的总质量增加
B. 铜电极上发生氧化反应
C. 电池工作一段时间后,甲池的c(SO42-)减小
D. 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
科目:高中化学 来源: 题型:
【题目】铜锌原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )

A. 锌电极上发生的反应:Zn2++2e-===Zn
B. 电池工作一段时间后,甲池的c(SO![]() )减小
)减小
C. 电流由锌电极经电流表流向铜电极
D. 电池工作一段时间后,乙池溶液的总质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中含酚废水中有机物可用C6H5OH表示,左、中、右室间分别以离子交换膜分隔。下列说法不正确的是

A. 右室电极为该电池的正极
B. 左室电极反应式可表示为:C6H5OH-28e-+11H2O=6CO2↑+28H+
C. 右室电极附近溶液的pH减小
D. 工作时左侧离子交换膜为阴离子交换膜,右侧离子交换膜为阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下列装置可测量一定质量的钢材中的含碳量(部分加持装置已略去)。下列有关判断正确的是( )

A. 实验时,先打开K1、K2,关闭K3,从a处通入N2,目的是排出装置中的O2
B. 点燃酒精灯前,需要打开K1、关闭K2,打开K3、K1起到平衡气压的作用
C. 装置②中的酸性KMnO4溶液吸收SO2,装置③盛有浓硫酸,起到干燥作用
D. 实验前后需称取装置④和装置⑤的质量,才能准确地测得钢材的含碳量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾常用作消毒剂、水质净化剂等。工业上用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)制备高锰酸钾晶体的一种工艺流程如下:
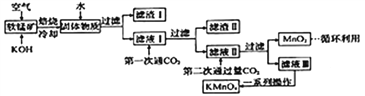
回答下列问题:
(1)焙烧过程中发生的主要反应为MnO2+KOH+O2![]() K2MnO4+H2O,该反应配平后MnO2与O2的系数比为________。采用对空气加压的方法可提高MnO2的利用率。原因是__________________________。
K2MnO4+H2O,该反应配平后MnO2与O2的系数比为________。采用对空气加压的方法可提高MnO2的利用率。原因是__________________________。
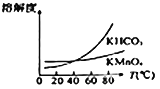
(2)滤渣Ⅱ是________,第一次通CO2不能用稀盐酸代替的原因是____________________________。
(3)第二次通入过量CO2生成MnO2的离子方程式为__________________________。
(4)由下图可知,从滤液Ⅲ得到高锰酸钾晶体需经过________、________、洗涤等一系列操作。
(5)1t含MnO287%的软锰矿,理论上最多可制得________tKMnO4晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下列实验方法操作,能达到要求的是( )
A.用托盘天平称量25.20g氯化钠固体
B.实验室制取蒸馏水时,圆底烧瓶中加些碎瓷片可防止暴沸
C.加热饱和FeCl3溶液制备Fe(OH)3胶体
D.将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】r—Fe2O3是一种具有磁性、催化、气敏的纳米材料。一种以硫铁矿烧渣等为原料制备r—Fe2O3的流程如下:

(1)下列有关“还原焙烧”工序的说法正确的是_____(填字母)。
a.焦炭应少量,空气应过量
b. 焙烧过程均为吸热反应,需用电炉持续加热反应器
c.“还原焙烧”的主要反应为 3C+2O2![]() 2CO+CO2、Fe2O3+CO
2CO+CO2、Fe2O3+CO![]() 2FeO+CO2
2FeO+CO2
(2)“浸取”前需将焙烧生成的熔体粉碎,其目的是_____________________。
(3)已知三种金属离子开始沉淀和完全沉淀的pH如下表:
Fe3+ | Fe2+ | Al3+ | |
开始沉淀的pH | 2.2 | 7.5 | 4.1 |
完全沉淀的pH | 3.5 | 9.5 | 5.4 |
则“调pH”时,溶液的pH范围为_______________。
(4)滤渣1的主要成分为_________(填化学式);“沉铁”时发生反应的离子方程式为___________。
(5)“过滤2”时需用蒸馏水洗涤,能证明沉淀已洗涤干净的方法是_________;沉淀缓慢氧化为铁黄的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径。
(1)将煤转化成水煤气的反应:C(s)+H2O(g)![]() CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中增大H2的浓度(其他条件保持不变),此反应的△H_____(填“增大”、“减小”或“不变”)。
CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中增大H2的浓度(其他条件保持不变),此反应的△H_____(填“增大”、“减小”或“不变”)。
(2)CO2制备甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.0 kJ·mol-1,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0 kJ·mol-1,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。

①该反应化学平衡常数K的表达式是_________。
②0~9 min时间内,该反应的平均反应速率v(H2)=_________。
③在相同条件下,密闭容器的体积缩小至0.5 L时,此反应达平衡时放出的热量(Q)可能是_________(填字母序号)kJ。
a. 0<Q<29.5 b. 29.5<Q<36.75
c. 36.75<Q<49 d. 49<Q<98
④在一定条件下,体系中CO2的平衡转化率(![]() )与L和X的关系如图所示,L和X分别表示温度或压强。
)与L和X的关系如图所示,L和X分别表示温度或压强。

i. X表示的物理量是_________。
ii. 判断L1与L2的大小关系:L1________L2(填“<”,“=”或“>”),并简述理由:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com