
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 将1mol Cl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA
B. 100g CaCO3晶体和100g KHSO4晶体中含有的离子数分别为2NA和3NA
C. 标准状况下,4.48L NO和2.24L O2混合后,原子总数为0.6NA
D. 已知3BrF3 + 5H2O=HBrO3 + Br2 + 9HF + O2↑,若有5mol H2O参加反应,则被水还原的BrF3分子数目为2NA
【答案】C
【解析】A.氯气溶于水,部分与水反应,部分以氯气分子形式存在,依据氯原子个数守恒,将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和小于2NA,故A错误;B.100gCaCO3晶体的物质的量为1mol,含有1mol钙离子和1mol碳酸根离子;100gKHSO4晶体的物质的量为1mol,含有1mol钾离子和1mol硫酸氢根离子;离子数均为2NA,故B错误;C.标准状况下,4.48LNO和2.24LO2混合后,恰好反应生成4.48LNO2,物质的量为![]() =0.2mol,根据质量守恒定律,原子总数为0.6NA,故C正确;D.在反应3BrF3+5H2O=HBrO3+ Br2+9HF+O2中,元素化合价变化情况为:溴元素由+3价升高为+5价,溴元素由+3价降低为0价,氧元素化合价由-2价升高为0价,所以BrF3既起氧化剂也起还原剂作用,同时水也起还原剂作用,所以5molH2O参加反应,则被水还原的BrF3的分子数目小于3NA,故D错误;故选C。
=0.2mol,根据质量守恒定律,原子总数为0.6NA,故C正确;D.在反应3BrF3+5H2O=HBrO3+ Br2+9HF+O2中,元素化合价变化情况为:溴元素由+3价升高为+5价,溴元素由+3价降低为0价,氧元素化合价由-2价升高为0价,所以BrF3既起氧化剂也起还原剂作用,同时水也起还原剂作用,所以5molH2O参加反应,则被水还原的BrF3的分子数目小于3NA,故D错误;故选C。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( O-16 )
A. 1 mol CO2的质量为44 g/mol B. H2SO4的摩尔质量为98
C. 标准状况下,气体摩尔体积为22.4 L D. O2的相对分子质量为32
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关现在的长式元素周期表的判断中正确的是( )
A. 从左向右数第七纵行是ⅦA族 B. 从左向右数第十一纵行是ⅠB族
C. ⅠA族全部是金属元素 D. 第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是重要的化工原料,可以制备一系列物质.有关下列流程的说法中,正确的是( ) 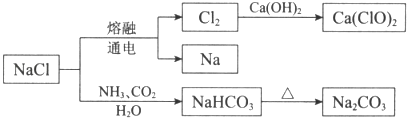
A.NaHCO3的热稳定性好
B.如图所示转化涉及的反应都是氧化还原反应
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下面短文.
原子核究竟是什么形状的?
你也许会说,原子核应该是球形的吧.没错,对于大多数的原子而言,它们的原子核都是球形(如图1)或者比较接近球形的椭球形,就像橄榄球一样(如图2).但是,科学家也发现极少数的原子核中的质子和中子会聚集成罕见的梨形(如图3).
要想验证原子核是否为梨形,最直接的方法就是寻找不同核状态间的八极形变(octupole transition),这是梨形结构原子核特有的现象.利用这一手段,研究人员先后确认了224Ra、226Ra及其他一些重原子核均为梨形的,但一直没有发现质量数小于200的梨形原子核.
近日,来自美国、英国和法国的一组科研团队制备了144Ba原子束,使其与铅箔发生碰撞并进入激发态.通过分析原子核产生的伽马射线光谱,研究人员发现几次八极形变的强度是核结构模型中预测数值的两倍多.由此,确认了144Ba的原子核也是梨形的.
请回答下列问题:
(1)224Ra原子核的形状是 .
(2)224Ra和226Ra可以互称为 .
(3)Ba元素的原子序数是56,则144Ba原子核中的中子数是 .
(4)科学家确认144Ba的原子核是梨形的,其根据是(填序号).
a.直接观察了144Ba原子核的形状
b.由核结构模型做出的理论计算
c.发现了八极形变现象.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物广泛应用于高新材料领域,请回答下列有关问题:
(1)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图)。
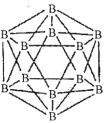
①在基态11B原子中,核外存在______对自旋相反的电子。
②若每个单元中有两个原子为l0B,其余为11B,则该单元结构的类型有______种。
(2)NaBH4是一种重要的储氢载体,其中涉及元素的电负性由小到大的顺序为________,BH4-离子的空间构型是_____________,与BH4-互为等电子体的的分子有___________。
(3)硼酸(H3BO3)为白色片状晶体,有与石墨相似的层状结构,则硼酸晶体中存在的作用力有共价键、_____、_______。与H3BO3酸性最接近的是__________(填字母)。
A.H4SiO4 B.H3PO4 C.HNO2
(4)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。如图是磷化硼晶体的晶胞,B原子的杂化方式是___________。立方相氮化硼晶体的熔点要比磷化硼体高,其原因是_____________。
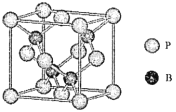
(5)己知磷化硼的晶胞参数a=478 pm,请列式计算该晶体的密度p=_____g.cm-3(用含NA的代数式表示即可,不需要计算出结果)。晶胞中硼原子和磷原子最近的核间距为_________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫、氯气、氯化亚砜等均为重要的工业原料。工业上用SO2、SCl2与Cl2反应合成氯化亚砜:SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g)。
(1)在373K时,向10 L的密闭容器中通入SO2、SCl2与Cl2均为0.20 mol,发生上述反应。测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同,p0为初始压强)。
t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
I | p | 6.0p0 | 6.7 p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
请回答下列问题:
①该反应的ΔH ______________(填“>”“<”或“=”)0。
②I反应开始至达到平衡时,v(SOCl2)= ______________。
③若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是__________________。
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点。

①A点的数值为______________。(已知:lg4=0.6)
②当升高到某一温度时,反应重新达到平衡,A点可能变化为______________点。
(3)已知反应S4(g) +4Cl2(g) = 4SCl2(g) 的ΔH=-4kJ·mol-1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJspan>、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为__________kJ
(4)常温下饱和亚硫酸溶液的物质的量浓度为1.25mol/L,电离常数为 Ka1= 1.54×10-2 、Ka2 = 1.02×10-7。10 mL 饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL。
①当V=10mL时,溶液中存在:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),则c(H+)___________c(OH-)(大于、小于、等于,下同)
②当V= a mL时,溶液中离子浓度有如下关系:c(Na+)=2c(SO32-)+c(HSO3-);当V= b mL时,溶液中离子浓度有如下关系:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3);则a _________b。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol A(g)和1 mol B(g)投入一容积可变的密闭容器中,发生如下可逆反应:A(g)+B(g)![]() xC(g),经测定C在反应混合物中的物质的量分数(C%)与时间(t)符合图Ⅰ所示关系,由此推断下列说法中正确的是
xC(g),经测定C在反应混合物中的物质的量分数(C%)与时间(t)符合图Ⅰ所示关系,由此推断下列说法中正确的是

A. 在上述可逆反应中x=3
B. 在图Ⅱ中p3>p4,Y轴表示混合气体的平均摩尔质量
C. 一定温度下,向达到平衡后的容器中再加入2 mol C,重新达到平衡时,C的物质的量分数增大
D. 在图Ⅱ中p3<p4,Y轴表示A的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下c(H+)最小的是下列各项中的( )
A.pH=0的溶液
B.0.5molL﹣1H2SO4
C.0.5molL﹣1HCl
D.0.5molL﹣1CH3COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com