
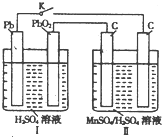
 高锰酸钾和二氧化锰是中学化学常用的化学试剂.根据下面相关的信息回答下列问题:
高锰酸钾和二氧化锰是中学化学常用的化学试剂.根据下面相关的信息回答下列问题:| 4mol |
| 4 |
| 2mol |
| 2 |


科目:高中化学 来源: 题型:
| A、一定温度下的可逆反应,只有达到平衡时才具有平衡常数 |
| B、改变外界条件使化学平衡状态改变时,平衡常数也一定改变 |
| C、对于一个确定的反应来说,平衡常数的数值越大,反应限度越大 |
| D、对于反应2NO2(g)?N2O4(g)正反应的平衡常数为K1,逆反应的平衡常数为K2,K1=K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ② |
| ① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加入AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加入足量NaOH溶液并加热 | 收集到气体1.12L(换算成标准状况) |
| 3 | 加入足量BaCl2溶液,将所得沉淀洗涤、干燥、称重;再向沉淀中加足量的稀盐酸,洗涤、干燥、称重 | 第一次称重读数为6.27g,第二次称重读数为2.33g |
查看答案和解析>>
科目:高中化学 来源: 题型:
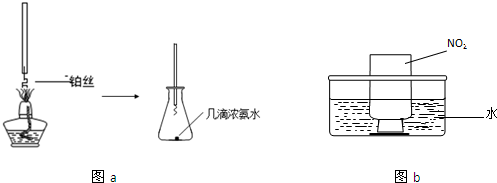
| 可能影响因素 | 实验操作 | 预期现象和结论 |
| 溶液的酸碱性 | 取少量0.5mol?L-1 Fe(NO3)3于试管中,加入几滴1mol?L-1 HNO3. | 棕黄色溶液颜色变浅,说明溶液酸性增强能抑制Fe(NO3)3的水解. |
| 盐的浓度 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化合反应一定是放热反应 |
| B、分解反应一定是吸热反应 |
| C、在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| D、破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com