
| A. | 任何化学反应都伴随着能量变化 | |
| B. | 化学反应中的能量变化都表现为热量变化 | |
| C. | 化学反应会引起化学键的变化 | |
| D. | 反应物的总能量低于生成物的总能量时,发生吸热反应 |
分析 A、化学反应的实质是旧键断裂,新键形成,过程中一定伴随能量变化;
B、化学能可以转化为热能、电能、光能等;
C、化学反应的实质是旧键断裂,新键形成;
D、吸热反应发生后产物的能量会升高.
解答 解:A、化学反应的实质是旧键断裂,新键形成,断裂旧键要吸收能量,形成新键要放出能量,所以任何化学反应都伴随着能量变化,故A正确;
B、化学能可以转化为热能、电能、光能等,则化学反应中的能量变化不一定都表现为热量变化,故B错误;
C、化学反应的实质是旧键断裂,新键形成,所以化学反应会引起化学键的变化,故C正确;
D、吸热反应发生后产物的能量会升高,即反应物的总能量低于生成物的总能量时,发生吸热反应,故D正确.
故选B.
点评 本题考查了化学反应中的能量变化,题目难度不大,注意把握化学反应的实质以及化学反应中能量变化的原因.


科目:高中化学 来源: 题型:选择题
| A. | 只有②③ | B. | 只有③⑥ | C. | 除①⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4═Na++HSO4- | B. | NaHCO3═Na++H++CO32- | ||
| C. | KClO3═K++Cl-+3O2- | D. | Al2(SO4)3═2Al3++3SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
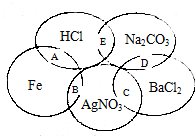 如图图为一五元环图案,小明在图案上依次写了五种物质,图中相交的两种物质均可发生化学反应,A、B、C、D、E表示其相应的化学反应.请回答下列问题:
如图图为一五元环图案,小明在图案上依次写了五种物质,图中相交的两种物质均可发生化学反应,A、B、C、D、E表示其相应的化学反应.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱:苛性碱、纯碱、火碱 | |
| B. | 碱性氧化物:氧化铜、氧化铁、七氧化二锰、二氧化硅 | |
| C. | 混合物:水煤气、矿泉水、盐酸 | |
| D. | 无丁达尔现象的分散系:氯化铁溶液、碘的四氯化碳溶液、蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:X2->Y->Z2+ | |
| B. | 单质的熔点:Z>W>Y | |
| C. | 能破坏水的电离平衡的离子为:Y-,Z2+,W- | |
| D. | 离子化合物ZX的熔点高,ZX可作为耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com