
| ||
| ||
|
| M-N |
| 31 |
| 84N-53M |
| 31×106 |
| 53M-22N |
| 31×106 |
| 53M-22N |
| 31×106 |
| 22.4(53M-22N) |
| 31×106 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L水中所含的分子数约为6.02×1023个 | ||
| B、1 mol Cl2参加反应转移电子数一定为2 NA | ||
C、标准状况下,aL氧气和氮气的混合物含有的分子数约为
| ||
| D、从1 L 0.5 mol/LNaCl溶液中取出100 mL,剩余溶液中NaCl物质的量浓度为0.45mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、直接排放含磷生活污水 |
| B、大量使用氟里昂作为冰箱制冷剂 |
| C、使用可降解塑料代替不可降解塑料 |
| D、使用不易分解的有机氯农药 |
查看答案和解析>>
科目:高中化学 来源: 题型:
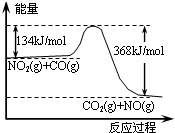 (1)某研究性学习小组的同学将一置于空气中的铝片投入浓CuCl2溶液中,铝片表面出现一层暗红色物质,此后铝片上开始产生大量气泡,溶液温度迅速上升,暗红色物质表面有黑色固体生成.
(1)某研究性学习小组的同学将一置于空气中的铝片投入浓CuCl2溶液中,铝片表面出现一层暗红色物质,此后铝片上开始产生大量气泡,溶液温度迅速上升,暗红色物质表面有黑色固体生成.
| 氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 1.0×10-15 | 1.0×10-29 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
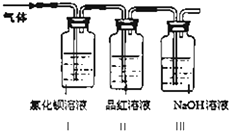
查看答案和解析>>
科目:高中化学 来源: 题型:
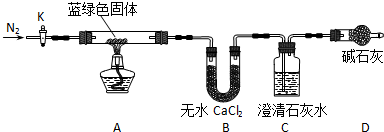
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com