
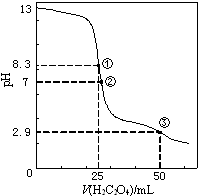
 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-) | |
| B. | 点②所示溶液中:c(HC2O4-)+2c(C2O42-)=c(Na+) | |
| C. | 点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| D. | 滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |
分析 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液,发生的反应为:H2C2O4+2NaOH=Na2C2O4+2H2O、H2C2O4+Na2C2O4=2NaHC2O4.
A.点①表示滴入25.00mL0.0500mol•L-1H2C2O4(二元弱酸)溶液,恰好完全反应,生成正盐草酸钠,结合电荷守恒判断;
B.点②溶液中,溶液呈中性,c(H+)=c(OH-),结合电荷守恒判断;
C.点③滴入0.0500mol•L-1H2C2O4(二元弱酸)溶液50.00mL,溶液溶质为NaHC2O4,溶液呈酸性;
D.点①为草酸钠成碱性,点②溶液溶质为NaHC2O4、Na2C2O4呈中性,点③溶液,溶质为NaHC2O4,呈酸性,介于②和③之间溶液NaHC2O4逐渐增多,溶液呈酸性.
解答 解:A.点①所示的溶液的体积25mL,草酸和氢氧化钠恰好完全反应,生成正盐草酸钠,草酸钠水解,所以溶液中,c(Na+)═2c(HC2O4-)+2c(H2C2O4)+2c(C2O42-)①,
根据电荷守恒得:关系式为:c(Na+)+c(H+)═c(HC2O4-)+c(OH-)+2c(C2O42-)②,将①代入②得:c(H+)+2c(H2C2O4)+c(HC2O4-)=c(OH-),故A错误;
B.点②溶液中,溶液呈中性,c(H+)=c(OH-)①,根据电荷守恒得:关系式为:c(Na+)+c(H+)═c(HC2O4-)+c(OH-)+2c(C2O42-)②,将①代入②得c(HC2O4-)+2c(C2O42-)=c(Na+),故B正确;
C.点③所示的溶液的体积50mL,草酸过量,溶液溶质为NaHC2O4,溶液呈酸性,草酸氢根离子的电离大于草酸氢根离子的水解,所以c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),故C错误;
D.点①为草酸钠成碱性,点②溶液呈中性为草酸钠、草酸氢钠,点③溶液呈酸性,介于②和③之间,随着草酸的滴入,NaHC2O4逐渐增多,所以可出现c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-),故D正确;
故选BD.
点评 本题考查酸碱混合的定性判断,题目难度中等,涉及物料守恒、电荷守恒等知识,试题知识点较多、综合性较强,解题时注意电荷守恒及物料守恒的应用,明确溶液酸碱性与溶液pH的关系为解答关键.


科目:高中化学 来源: 题型:多选题
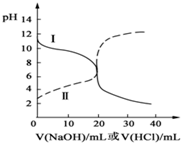 25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )| A. | 曲线Ⅱ:滴加溶液到10mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 曲线Ⅱ:滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)═2[c(OH-)-c(H+)] | |
| C. | 曲线Ⅰ:滴加溶液在10mL-20mL之间存在:c(Cl-)═c(NH4+)>c(OH-)═c(H+) | |
| D. | 曲线Ⅰ:滴加溶液到20mL时:c(Cl-)>c(NH4+)>c(H+)>c(NH3•H2O)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
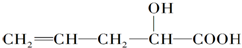 在不同条件下至少可能发生以下有机反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化,其中跟其分子结构中-OH有关的可能反应为( )
在不同条件下至少可能发生以下有机反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化,其中跟其分子结构中-OH有关的可能反应为( )| A. | ①②④⑤ | B. | ①②③⑤ | C. | ②③④⑤ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

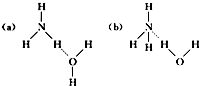
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
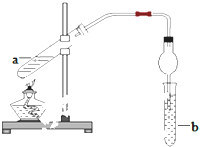 如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入5mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入5mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com