
【题目】25℃时,pH=2 的盐酸和醋酸溶液各 1 mL 分别加水稀释,pH 随溶液体积变化的曲线如图所示。下列说法正确的是
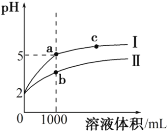
A.曲线 I 代表醋酸溶液的稀释过程
B.a 溶液的导电性比 c 溶液的导电性差
C.将 a、b 两溶液加热至 30℃(忽略溶质挥发),![]() 变大
变大
D.与相同浓度的NaOH 溶液恰好中和时,消耗a 溶液的体积比 b 溶液的体积大
【答案】D
【解析】
A.1 mL pH=2的盐酸加水稀释至1000 mL,溶液的pH=5;1 mL pH=2的醋酸加水稀释至1000 mL ,CH3COOH的电离平衡正向移动,溶液的pH<5,故曲线I代表盐酸的稀释过程,曲线II代表醋酸的稀释过程,故A错误;
B.盐酸加水稀释时,溶液中c(Cl-)、c(H+)减小,溶液的导电能力减弱,故a点溶液的导电性比c点溶液的导电性强,故B错误;
C.升高温度,CH3COOH的电离平衡正向移动,c(CH3COO-)增大,而c(Cl-)基本不变,所以![]() 变小,故C错误;
变小,故C错误;
D.pH=2的盐酸和醋酸相比,c(CH3COOH)>c(HCl),体积相等的两种溶液中n(CH3COOH)>n(HCl),与NaOH溶液发生中和反应时,CH3COOH消耗NaOH多,故消耗a 溶液的体积比 b 溶液的体积大,故D正确;
故答案为D。


科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某体学研究小组的同学分别设计了图甲、乙所示的实验。请回答相关问题:

(1)定性比较:图甲可通过观察_____,定性比较得出结论。有同学提出将CuSO4改为CuCl2更合理一些,其理由是______。
(2)定量比较:如图乙所示,实验时均以生成40 mL气体为标准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是________,实验中需要测量的数据是_______。
(3)将0.10 mol MnO2粉末加入到50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
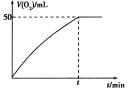
①写出H2O2在MnO2作用下发生反应的化学方程式:_______。
②H2O2的初始物质的量浓度为________。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应: PCl3(g)+Cl2(g)![]() PCl5(g)达平衡时,PCl5为0.40mol,如果此时再移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5(g)达平衡时,PCl5为0.40mol,如果此时再移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A.0.40molB.0.20mol
C.小于0.20molD.大于0.20mol,小于0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.图2表示压强对可逆反应2A(g)+2 B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3表示等质量的钾、钠分别与足量水反应,则甲为钠
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1000 molL-1的H2A溶液中,逐滴滴加0.1000 molL-1的NaOH 溶液,混合溶液PH随加入NaOH溶液体积的变化如图所示。下列说法正确的是
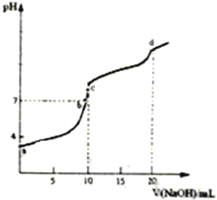
A.在a、b、c、d 四点中,由水电离出的c(H+)·c(OH-)不变
B.b点溶液存在关系:c(OH-)=c(H+)+c(H2A)-c(A2-)
C.C 点溶液中:c(Na+)>c(HA-)>c(OH-)>c(H2A)> c(H+)>c(A2-)
D.d 点溶液中: 2c(Na+)=c(HA-)+ C(A2-)+ c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同温度下,水溶液中![]() 的物质的量浓度和
的物质的量浓度和![]() 的物质的量浓度的关系如图所示.下列说法不正确的是
的物质的量浓度的关系如图所示.下列说法不正确的是![]()

A.M点和N点对应的溶液均呈中性
B.![]() 时,P点对应溶液中,水电离出来的
时,P点对应溶液中,水电离出来的![]() 可能为
可能为![]() 或
或![]()
C.![]() 时,
时,![]() 的NaOH溶液与
的NaOH溶液与![]() 的稀
的稀![]() 等体积混合,所得溶液的
等体积混合,所得溶液的![]()
D.向某溶液中加入酸或碱,均可以使该溶液从M点转化为N点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯酸钾熔化,粒子间克服了__的作用力;二氧化硅熔化,粒子间克服了__的作用力;碘的升华,粒子间克服了__的作用力.三种晶体的熔点由高到低的顺序是__.
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为__(填序号).
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有__,由非极性键形成的非极性分子有__,能形成分子晶体的物质是__,含有氢键的晶体的化学式是__,属于离子晶体的是__,属于原子晶体的是__,五种物质的熔点由高到低的顺序是__.
(4)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__.
(5)图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A.__;B.__;C.__;D.__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 密闭容器内,800℃时在反应
密闭容器内,800℃时在反应![]() 体系中,
体系中,![]() 随时间的变化如表所示:
随时间的变化如表所示:
时间/ | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)下图表示![]() 的变化的曲线是________。用
的变化的曲线是________。用![]() 表示
表示![]() 内该反应的平均速率
内该反应的平均速率![]() ________。
________。
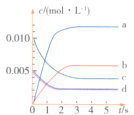
(2)能说明该反应已达到平衡状态的有________(填序号,下同)。
a ![]() b 容器内压强保持不变
b 容器内压强保持不变
c ![]() d 容器内密度保持不变
d 容器内密度保持不变
(3)为使该反应的反应速率增大,下列措施正确的有________。
a 适当升高温度 b 增大![]() 的浓度 c 选择高效催化剂解粉
的浓度 c 选择高效催化剂解粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学在实验室中组装如下图所示装置,请回答:
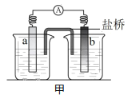
(1)从能量转化的角度看,该装置是将____(填能量转化的形式),符合该装置的化学反应类型一定是____反应。
(2)若 a 为锌片,b 为铜片,左右两侧烧杯中分别盛有ZnSO4溶液和CuSO4 溶液,则 b 极的电极反应式是_____,a 极可观察到的现象是______;导线中电子流动的 方向是_____(用“a→b”或“b→a”表示),盐桥中的阳离子向______(填“a”或“b”) 极方向移动。
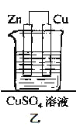
(3)另一种原电池乙如下图所示装置,甲、乙两种原电池中可更有效地将化学能转化为电能的是______(填“甲”或“乙”),其原因是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com