
| A. | Ba(OH)2 | B. | H2O2 | C. | Na2O2 | D. | CaCl2 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键.
解答 解:A.氢氧化钡中钡离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,属于离子化合物,故A错误;
B.双氧水分子中O-O、O-H原子之间分别存在非极性键、极性键,属于共价化合物,故B错误;
C.过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在非极性键,属于离子化合物,故C正确;
D.氯化钙中钙离子和氯离子之间只存在离子键,属于离子化合物,故D错误;
故选C.
点评 本题考查化学键和化合物的关系,明确物质构成微粒是解本题关键,知道离子键、共价键的区别,易错选项是D,注意氯化钙中两个氯离子之间不存在化学键.


科目:高中化学 来源: 题型:解答题
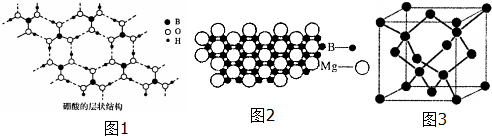
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 此物质是苯的同系物 | B. | 所有碳原子可能在同一平面上 | ||
| C. | 此分子的一氯取代产物有3种 | D. | 此物质分子式为C25H22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | a | b | c | d | e |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A. | 元素a、c、d的最高价氧化物都属于酸性氧化物 | |
| B. | 元素c、d、e的氢化物稳定性和最高价氧化物对应水化物的酸性均依次增强 | |
| C. | 元素周期表中,元素c位于金属和非金属分界线附近,其单质常用作光电池材料 | |
| D. | 元素b、d、e的原子半径和离子半径均依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、④HCHO,其中碳原子采取sp2杂化的分子有①③④
、④HCHO,其中碳原子采取sp2杂化的分子有①③④
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
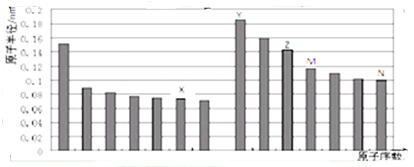
| A. | 金属性:Z>Y | |
| B. | 气态氢化物的稳定性:M>N | |
| C. | X和Y形成的化合物中可能含共价键 | |
| D. | Z元素的离子半径是本周期元素离子半径最小的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| 取适量铁钉与稀硫酸浸泡后的溶液于试管中,依次滴入适量的氯水和几滴KSCN溶液,振荡. | 溶液呈血红色 | 乙同学的观点正确 (填“正确”或“错误”). |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com