
【题目】为了使Na2S溶液中c(Na+)/c(S2-)的比值变小,可采取的措施是( )
①适量盐酸 ②适量NaOH(s) ③适量KOH(s) ④适量KHS(s) ⑤加水 ⑥适量Cl2溶液⑦加热
A. ②③④ B. ①②⑤⑥⑦
C. ②③ D. ③④
科目:高中化学 来源: 题型:
【题目】25℃时,常见的无机酸在水溶液中的电离子平衡常数如表,下列选项正确的是( )
氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
K=4.9×10﹣10 | K1=4.4×10﹣7 K2=4.7×10﹣11 | K=6.61×10﹣4 |
A. 氰化钠溶液中通入少量CO2:2CN﹣+H2O+CO2═2HCN+CO32﹣
B. NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN﹣)>c(HCN)>c(H+)>c(OH-)
C. 25℃时CN-的水解平衡常数约为1.6×10-5
D. NaCN与HCN的混合溶液中:2c(Na+)=c(CN-)+c(HCN)
【答案】C
【解析】A、根据电离平衡常数知,酸性H2CO3>HCN>HCO3-,结合强酸制取弱酸知,氰化钠溶液中通入少量CO2只能发生以下反应CN﹣+H2O+CO2=HCN+ HCO3-,故A错误;B、NaCN溶液显碱性,HCN溶液显酸性,选项中没有已知混合时NaCN与HCN量的相对大小,无法判断溶液的酸碱性,也无法判断离子浓度大小,故B错误;C、HCN的电离常数K与CN的水解常数Kh的乘积等于Kw,则有Kh=![]() ≈1.6×10-5,故C正确;D、等体积等浓度的NaCN溶液与HCN溶液混合所得溶液的物料守恒为:2c(Na+)=c(CN)+c(HCN),而选项中没有已知NaCN与HCN量的相对大小,无法判断,故D错误。故选C。
≈1.6×10-5,故C正确;D、等体积等浓度的NaCN溶液与HCN溶液混合所得溶液的物料守恒为:2c(Na+)=c(CN)+c(HCN),而选项中没有已知NaCN与HCN量的相对大小,无法判断,故D错误。故选C。
【题型】单选题
【结束】
19
【题目】室温下,向20.00 mL 0.8molL﹣1一元酸HA溶液中滴入0.8 molL﹣1的NaOH溶液,溶液的pH和温度随加入NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )
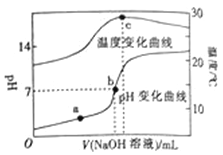
A. 常温下,1.0 molL﹣1HA的溶液的pH=0
B. a、b、c三点,a点混合溶液中c(Na+)最大
C. a、b两点的溶液中水的离子积Kw(a)=Kw(b)
D. c点时消耗NaOH溶液的体积为20.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 位于同一周期,下列关系正确的是
位于同一周期,下列关系正确的是
A. 还原性:As3->S2->Cl-
B. 热稳定性:HCl>AsH3>HBr
C. 原子半径:As>Cl>P
D. 酸性:H3AsO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CN-可以造成水体污染,某小组采用如下方法对污水进行处理。
Ⅰ![]() 双氧水氧化法除NaCN。
双氧水氧化法除NaCN。
(1)NaCN的电子式为____________________________。
(2)碱性条件下加入双氧水除CN-,可得到纯碱和一种无色无味的无毒气体,该反应的离子方程式为________________。
Ⅱ.CN-和Cr2O72-联合废水处理法。
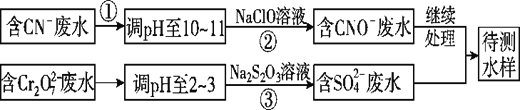
(3)②中反应后无气体放出,该反应的离子方程式为_____________________。
(4)步骤③中,每处理0.4mol Cr2O72-,至少消耗Na2S2O3________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1的一元酸HA与0.1 mol·L-1的NaOH溶液等体积混合后,所得溶液pH>7,下列说法正确的是
A.混合前一元酸HA的c(H+)=0.1 mol·L-1
B.该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
C.HA在水溶液中的电离方程式:HA = H+ + A-
D.该混合溶液中:c(A-)+ c(HA)=0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把a、b、c、d四种金属片浸入稀硫酸中,用导线两两相连,可以形成原电池。若a、b相连时,a为负极;c、d相连时,c溶解;a、c相连时,c极上产生大量气泡;b、d相连时,b极上有大量气泡。则四种金属的活动性顺序是
A.a>c>d>bB.c>a>b>dC.a>c>b>dD.c>a>d>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(反应条件及副产物已略去)。
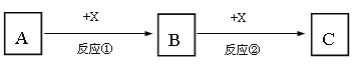
(1)若A、B、C均为含有同种非金属元素的化合物,A为使湿润的红色石蕊试纸变蓝的气体,B接触空气立刻变为C,则反应①的化学方程式为_______________________。
(2)若A、B、C为焰色反应均呈黄色的化合物,X为无色无味气体,则反应②的离子方程式为_____________________________________________。
(3)若A、B、C均为含有同种金属元素的化合物,X是强碱,则反应②的离子方程式为________________________________________________。
(4)若A为单质Fe,X为稀硝酸,若向B的溶液中加入氢氧化钠溶液,现象为________________________________________。
(5)若A和X均为单质,B为可使品红溶液褪色的气体,则反应②的化学方程式为_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2001年诺贝尔化学奖授予"手性碳原子的催化氢化,氧化反应"研究领域作出贡献的美,日三位科学家,手性分子具有镜像异构及光学活性,下列分子中具有光学活性的是
A.CBr2F2 B.CH3CH2OH
C.CH3CH2CH3 D.CH3CH(OH)COOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的 SO2 气体和 SO3 气体相比较,下列叙述中正确的是
A. 物质的量之比为 4:5 B. 密度比为 4:5
C. 体积比为 1:1 D. 原子数之比为 3:4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com