
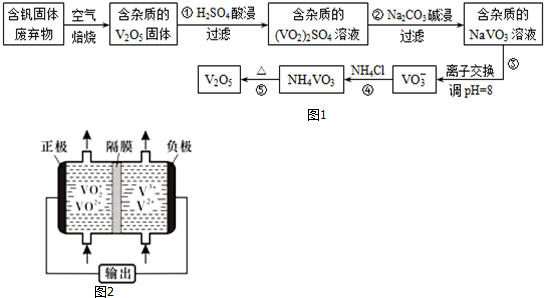
| ĪļÖŹ | V2O5 | NH4VO3 | VOSO4 | £ØVO2£©2SO4 |
| ČܽāŠŌ | ÄŃČÜ | ÄŃČÜ | æÉČÜ | Ņ×ČÜ |
·ÖĪö ·“Ó¦¢ŁÓĆĮņĖįČܽāŗ¬·°¹ĢĢå·ĻĘśĪļ£Øŗ¬ÓŠSiO2”¢Al2O3¼°ĘäĖū²ŠŌü£©£¬Éś³É£ØVO2£©2SO4ŗĶĮņĖįĀĮ£¬SiO2µČ²»ČÜŠŌŌÓÖŹ¹żĀĖ³żČ„£»·“Ó¦¢ŚŹĒÓĆĢ¼ĖįÄĘČÜŅŗÓė£ØVO2£©2SO4ŗĶĮņĖįĀĮ·“Ó¦£¬Óė£ØVO2£©2SO4·“Ӧɜ³ÉNaVO3£¬Ģ¼ĖįøłĄė×ÓÓėĀĮĄė×ÓĖ®½āĻą»„“Ł½ųÉś³ÉAl£ØOH£©3³Įµķ£»·“Ó¦¢ÜŹĒNaVO3ČÜŅŗÓėĀČ»Æļ§·“Ӧɜ³ÉNH4VO3³Įµķ£¬¼ÓČČNH4VO3·Ö½āĪŖV2O5£¬¾Ż“Ė½ā“š£Ø1£©£Ø2£©£Ø3£©£»
£Ø4£©¾ŻŅŃÖŖČČ»Æѧ·½³ĢŹ½ŗĶ“żĒóČČ»Æѧ·½³ĢŹ½£¬ĄūÓĆøĒĖ¹¶ØĀɼĘĖć£»
£Ø5£©·°ŅŗĮ÷µē³Ų·ÅµēŹ±øŗ¼«·¢ÉśŃõ»Æ·“Ó¦£¬Õż¼«·¢Éś»¹Ō·“Ó¦£¬³äµēŹ±£¬Ńō¼«·¢ÉśŃõ»Æ·“Ó¦£»
£Ø6£©ĻČ¾Ż·“Ó¦·½³ĢŹ½ŗĶµĪ¶ØŹż¾Ż¼ĘĖć£ØVO2£©2SO4ČÜŅŗÖŠc£ØVO2+£©µÄĪļÖŹµÄĮæÅØ¶Č£¬ŌŁ¼ĘĖćøĆ£ØVO2£©2SO4ČÜŅŗÖŠ·°µÄŗ¬Į森
½ā“š ½ā£ŗ·“Ó¦¢ŁÓĆĮņĖįČܽāŗ¬·°¹ĢĢå·ĻĘśĪļ£Øŗ¬ÓŠSiO2”¢Al2O3¼°ĘäĖū²ŠŌü£©£¬Éś³É£ØVO2£©2SO4ŗĶĮņĖįĀĮ£¬SiO2µČ²»ČÜŠŌŌÓÖŹ¹żĀĖ³żČ„£»·“Ó¦¢ŚŹĒÓĆĢ¼ĖįÄĘČÜŅŗÓė£ØVO2£©2SO4ŗĶĮņĖįĀĮ·“Ó¦£¬Óė£ØVO2£©2SO4·“Ӧɜ³ÉNaVO3£¬Ģ¼ĖįøłĄė×ÓÓėĀĮĄė×ÓĖ®½āĻą»„“Ł½ųÉś³ÉAl£ØOH£©3³Įµķ£»·“Ó¦¢ÜŹĒNaVO3ČÜŅŗÓėĀČ»Æļ§·“Ӧɜ³ÉNH4VO3³Įµķ£¬¼ÓČČNH4VO3·Ö½āĪŖV2O5£¬
£Ø1£©ÓĆĮņĖįČܽāŗ¬·°¹ĢĢå·ĻĘśĪļ£Øŗ¬ÓŠSiO2”¢Al2O3¼°ĘäĖū²ŠŌü£©£¬Éś³É£ØVO2£©2SO4ŗĶĮņĖįĀĮ£¬ČÜŅŗÖŠµÄŃōĄė×Ó³żĒāĄė×ÓĶā»¹ÓŠVO2+ŗĶAl3+£¬
¹Ź“š°øĪŖ£ŗVO2+ŗĶAl3+£»
£Ø2£©ŗ¬ŌÓÖŹµÄ£ØVO2£©2SO4ČÜŅŗÓĆĢ¼ĖįÄĘČÜŅŗ¼ī½žÉś³Éŗ¬ŌÓÖŹµÄNaVO3ČÜŅŗ£¬Al£ØOH£©3²»ČÜÓŚČõ¼ī£¬ĖłŅŌ·“Ó¦¢Ś¼ī½žŗóĀĖ³öµÄ¹ĢĢåÖ÷ŅŖ³É·ÖŹĒAl£ØOH£©3£¬
¹Ź“š°øĪŖ£ŗAl£ØOH£©3£»
£Ø3£©¾Ż¹¤ŅÕĮ÷³ĢĶ¼æÉÖŖ£¬·“Ó¦¢ÜµÄĄė×Ó·½³ĢŹ½ĪŖVO3-+NH4+=NH4VO3”ż£¬¹Ź“š°øĪŖ£ŗVO3-+NH4+=NH4VO3”ż£»
£Ø4£©ŅŃÖŖ¢Ł4Al£Øs£©+3O2£Øg£©ØT2Al2O3£Øs£©”÷H1=-a kJ/mol
¢Ś4V£Øs£©+5O2£Øg£©ØT2V2O5£Øs£©”÷H2=-b kJ/mol
¾ŻøĒĖ¹¶ØĀÉ£¬£Ø¢Ł”Į5-¢Ś”Į3£©”Ā2µĆ£ŗ10Al£Øs£©+3V2O5£Øs£©=5Al2O3£Øs£©+6V£Øs£©”÷H=-$\frac{5a-3b}{2}$kJ/mol£¬
¹Ź“š°øĪŖ£ŗ10Al£Øs£©+3V2O5£Øs£©=5Al2O3£Øs£©+6V£Øs£©”÷H=-$\frac{5a-3b}{2}$kJ/mol£»
£Ø5£©·°ŅŗĮ÷µē³Ų·ÅµēŹ±øŗ¼«·¢ÉśŃõ»Æ·“Ó¦£¬¾ŻĶ¼æÉÖŖ£¬µē¼«·“Ó¦Ź½ĪŖV2+-e-=V3+£¬Õż¼«·¢Éś»¹Ō·“Ó¦£¬³äµēŹ±£¬Ńō¼«·¢ÉśŃõ»Æ·“Ó¦£¬µē¼«·“Ó¦Ź½ĪŖVO2+-e-+H2O=VO2++2H+£»
¹Ź“š°øĪŖ£ŗV2+-e-=V3+£»VO2+-e-+H2O=VO2++2H+£»
£Ø6£©¾ŻµĪ¶ØŹż¾Ż£¬½įŗĻĄė×Ó·½³ĢŹ½c£ØVO2+£©=$\frac{2”Į0.025L”Į0.100mol/L}{0.024L}$=0.2083mol/L£¬ĖłŅŌ1LČÜŅŗÖŠŗ¬VµÄÖŹĮæĪŖ0.2083mol/L”Į1L”Į51g/mol=10.6g£¬
¹Ź“š°øĪŖ£ŗ10.6£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹ·ÖĄėŗĶĢį“棬ĪŖøßĘµæ¼µć£¬Éę¼°Ōµē³ŲŗĶµē½ā³ŲŌĄķ”¢µĪ¶ØŹµŃé¼°¼ĘĖć”¢øĒĖ¹¶ØĀÉ”¢ĪļÖŹ·ÖĄėŗĶĢį“æµČÖŖŹ¶µć£¬Ć÷Č·ŹµŃéŌĄķ¼°ĪļÖŹŠŌÖŹ”¢»ł±¾²Ł×÷·½·ØµČŹĒ½ā±¾Ģā¹Ų¼ü£¬ÄѵćŹĒ·ÖĪöĮ÷³ĢĶ¼ÖŠĆæŅ»²½æÉÄÜ·¢ÉśµÄ·“Ó¦»ņ»ł±¾²Ł×÷·½·Ø£¬×¢Ņā½įŗĻĢāøųŠÅĻ¢·ÖĪö½ā“š£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ŹµŃé²Ł×÷ | ŹµŃéÄæµÄ | |
| A | Ļņ±½ŗĶ±½·Ó»ģŗĻČÜŅŗÖŠµĪ¼Ó¹żĮæÅØäåĖ® | ³żČ„»ģŗĻČÜŅŗÖŠµÄ±½·Ó |
| B | Ļņ“ż²āŅŗÖŠ¼ÓČė±„ŗĶĢ¼ĖįÄĘČÜŅŗ | ¼ų±šŅŅĖį”¢ŅŅĖįŅŅõ„”¢ŅŅ“¼ |
| C | Ļņ3mL5%CuSO4ČÜŅŗÖŠµĪ¼Ó3-4µĪ1%ĒāŃõ»ÆÄĘČÜŅŗ£¬ŌŁĻņĘäÖŠ¼ÓČė0.5mLŅŅČ©£¬¼ÓČČ | ¼ģŃéČ©»ł |
| D | ½«äåŅŅĶéÓėĒāŃõ»ÆÄĘČÜŅŗ¹²ČČ£¬ĄäČ“£¬¼ĢŠųµĪ¼ÓĻõĖįŅųČÜŅŗ | ¼ģŃéäåŅŅĶéÖŠµÄäåŌŖĖŲ |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 4ÖÖ”¢3ÖÖ | B£® | 3ÖÖ”¢4ÖÖ | C£® | 6ÖÖ”¢2ÖÖ | D£® | 2ÖÖ”¢6ÖÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 4.4gCO2”¢N2O³ÉµÄ»ģŗĻĘųĢåÖŠŗ¬ÓŠµÄÖŹ×ÓŹżĪŖ2.2NA | |
| B£® | 7.8gNa2O2ÖŠŅõĄė×ÓŹżÄæĪŖ0.2NA | |
| C£® | 2L0.5mol•L-1£ØNH4£©2SO4ČÜŅŗÖŠŗ¬ÓŠµÄNH4+Ąė×ÓŹżĪŖ2NA | |
| D£® | »Æѧ·“Ó¦ÖŠĆæĻūŗÄ1molO2£¬×ŖŅʵĵē×ÓŹżŅ»¶ØŹĒ4NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1s22s22p5 | B£® | 1s22s22p2 | C£® | 1s22s22p63s1 | D£® | 1s22s22p63s2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com