
【题目】下列关于有机物的说法正确的是
A. 蔗糖、果糖和麦芽糖都是双糖
B. 除去乙烷中的乙烯时,通入氢气并加催化剂加热
C. 油脂在酸性或碱性条件下水解都可得到甘油
D. 等物质的量的甲烷和乙酸完全燃烧消耗氧气的物质的量前者多
【答案】C
【解析】A.果糖分子式为C6H12O6属于单糖;
B.易混入氢气杂质;
C. 油脂酸性条件下水解生成高级脂肪酸和甘油,在碱性条件下水解生成高级脂肪酸盐和甘油;
D. 甲烷的分子式为CH4,乙酸的分子式为C2H4O2,将C2H4O2写成CH4![]() CO2后不难发现,等物质的量的甲烷和乙酸完全燃烧消耗氧气的物质的量相同。
CO2后不难发现,等物质的量的甲烷和乙酸完全燃烧消耗氧气的物质的量相同。
详解:A. 蔗糖和麦芽糖都是双糖,但果糖属于单糖,故A错误;
B.因不能确定乙烯的含量,易混入氢气杂质,且反应在实验室难以完成,故B错误;
C. 油脂酸性条件下水解生成高级脂肪酸和甘油,在碱性条件下水解生成高级脂肪酸盐和甘油,所以都可得到甘油,故C正确;
D. 甲烷的分子式为CH4,乙酸的分子式为C2H4O2,将C2H4O2写成CH4![]() CO2后不难发现,等物质的量的甲烷和乙酸完全燃烧消耗氧气的物质的量相同,故D错误;
CO2后不难发现,等物质的量的甲烷和乙酸完全燃烧消耗氧气的物质的量相同,故D错误;
所以C选项是正确的。


科目:高中化学 来源: 题型:
【题目】碘在工农业生产和日常生活中有重要用途。

(1)上图为海带制碘的流程图。步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是____________________(从下列仪器中选出所需的仪器,用标号字母填写)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.冷凝管
步骤④发生反应的离子方程式为______________________________________________。
若步骤⑤采用裂化汽油提取碘,后果是____________________________。
(2)溴化碘(IBr)的化学性质类似于卤素单质,如能与大多数金属反应生成金属卤化物,跟水反应的方程式为:IBr+H2O==HBr+HIO,下列有关IBr的叙述中错误的是:________。
A.固体溴化碘熔沸点较高
B.在许多反应中,溴化碘是强氧化剂
C.跟卤素单质相似,跟水反应时,溴化碘既是氧化剂,又是还原剂
D.溴化碘跟NaOH溶液反应生成NaBr、NaIO和H2O
(3)为实现中国消除碘缺乏病的目标。卫生部规定食盐必须加碘盐,其中的 碘以碘酸钾(KIO3)形式存在。可以用硫酸酸化的碘化钾淀粉溶液检验加碘盐,下列说法正确的是___。
A.碘易溶于有机溶剂,可用酒精萃取碘水中的I2
B.检验加碘盐原理:IO3-+5I-+3H2O=3I2+6OH-
C.在KIO3溶液中加入几滴淀粉溶液,溶液变蓝色
D.向某无色溶液中加入氯水和四氯化碳,振荡,静置,下层呈紫色,说明原溶液中有I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中 ![]() 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10mLpH=11的NaOH溶液,混合液的pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500mLKNO3和Cu(NO3)2的混合溶液中c(NO3﹣)=6.0molL﹣1 , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
A.原混合溶液中c(K+)为2molL﹣1
B.上述电解过程中共转移2mol电子
C.电解得到铜的物质的量为0.5mol
D.电解后溶液中c(H+)为2molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S.已知:1molCO(g)与适量的SO2(g)反应生成S(s)和CO2(g)时,放出135kJ的热量,则此反应的热化学方程式为.
(2)用CH4催化还原NOx也可以消除氮氧化物的污染.例如: ①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
若1molCH4(g)直接将NO2(g)还原至N2(g),整个过程中放出的热量为867kJ,则△H2= .
(3)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可转化为N2(g)和CO2(g)得到净化.已知 2NO(g)+2CO(g)N2(g)+2CO2(g)△H<0 在25℃、101kPa下,将2molNO、2.4molCO通入固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示.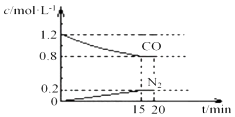
①0~15min 内,v(CO2)= , 25℃时该反应平衡常数为(该空保留2位小数);
②20min 时若改变反应条件,导致NO浓度下降,则改变的条件不可能是(填选项序号).
a.升高温度 b.增加CO的量 c.降低温度 d.扩大容积
(4)SO2尾气常用饱和Na2SO3溶液吸收,减少SO2气体污染并可得到重要的化工原料NaHSO3 . 已知NaHSO3溶液同时存在以下两种平衡: ①HSO3﹣SO32﹣+H+ , ②HSO3﹣+H2OH2SO3+OH﹣;常温下,0.1 mol/L NaHSO3溶液的pH<7,则该溶液中c(H2SO3)c(SO32﹣)(填“>”、“=”或“<”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按钠、钾、铷、铯的顺序,下列有关叙述正确的是
A. 其氢氧化物中碱性最强的是NaOH
B. 单质还原能力最强的是钠原子
C. 单质的熔点逐渐增大
D. 原子半径随核电荷数的增大而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)氯化硼的熔点为10.7℃,沸点为12.5℃。在氯化硼分子中,Cl—B—Cl键角为120°,它可以水解,水解产物之一是氯化氢。下列对氯化硼的叙述中正确的是( )
A. 氯化硼是原子晶体
B. 熔化时,氯化硼能导电
C. 氯化硼分子是一种非极性分子
D. 氯化硼水解得到两种酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com