

| A. | 该试剂的物质的量浓度为9.2 mol•L-1 | |
| B. | 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L | |
| C. | 硫酸是强电解质 | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
分析 A、根据c=$\frac{1000ρω}{M}$计算该硫酸溶液的物质的量浓度;
B.根据Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O及Cu与稀硫酸不反应来分析;
C、硫酸是强电解质;
D、根据密度和体积计算溶液的总质量,根据硫酸的密度大于水的密度,判断质量分数关系;
解答 解:A、该硫酸溶液的物质的量浓度为$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,故A错误;
B、发生反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,随反应的进行,浓硫酸变为稀硫酸,Cu与稀硫酸不反应,故生成二氧化硫的物质的量小于0.05L×18.4mol/L×0.5×22.4L/mol=10.4L,故B错误;
C、硫酸是强酸是强电解质,故C正确;
D、等体积混合,设体积分别为Vml,98%的H2SO4溶液密度为ρ1,水密度为ρ2,则混合后溶液的质量分数为w(H2SO4)=$\frac{V•ρ1×98%}{V•ρ1+V•ρ2}$×100%=$\frac{ρ1×98%}{ρ1+ρ2}$×100%,因硫酸的密度大于水的密度,则ρ1>ρ2,所以=$\frac{ρ1×98%}{ρ1+ρ2}$×100%>49%,故D错误;
故选C.
点评 本题考查溶液浓度有关计算,题目难度中等,注意硫酸的浓度越大密度越大,B选项为易错点,注意浓度的影响.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
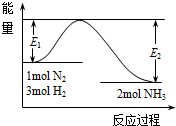 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加C,B的平衡转化率不变 | |
| B. | 此时,B的平衡转化率是35% | |
| C. | 增大该体系的压强,平衡向右移动,化学平衡常数增大 | |
| D. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2:7或5:4 | B. | 2:1或5:4 | C. | 4:5或7:2 | D. | 2:1或7:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗涤油污常用热的碳酸钠溶液 | |
| B. | 无法利用Na2S溶液和AlCl3溶液制备Al2S3 | |
| C. | 金属焊接中,可用NH4Cl溶液作除锈剂 | |
| D. | 工业上用FeCl3溶液腐蚀铜制印刷电路板 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com