
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体及上层液体均从下口放出 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
分析 A.萃取剂的选择与密度无关;
B.温度计的水银球应靠近蒸馏烧瓶的支管口处;
C.下层液体从下口放出,上层液体从上口倒出;
D.当加热到有少量液体剩余时停止加热.
解答 解:A.萃取剂的密度不一定比水大,只要符合萃取剂与原溶剂互不相溶,溶质在萃取剂中的溶解度比在水中大,且萃取剂与水的密度有差别即可,故A错误;
B.蒸馏操作时,温度计用于测量馏分温度,则温度计水银球应靠近蒸馏烧瓶的支管口处,故B正确;
C.分液操作时,为防止药品污染,先将分液漏斗中下层液体从下口放出,再将上层液体从上口放出,故C错误;
D.在蒸发操作的过程中,当加热到有少量液体剩余时停止加热,利用余热蒸干,故D错误.
故选B.
点评 本题考查了化学实验方案的评价,题目难度不大,明确常见化学实验基本操作方法为解答关键,试题侧重基础知识的考查,有利于提高学生的化学实验能力.


科目:高中化学 来源: 题型:解答题
| N2+3H2?2NH3 | ||||
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、SO3都是极性分子 | |
| B. | KF是离子化合物,HF为共价化合物 | |
| C. | 在NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| D. | PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
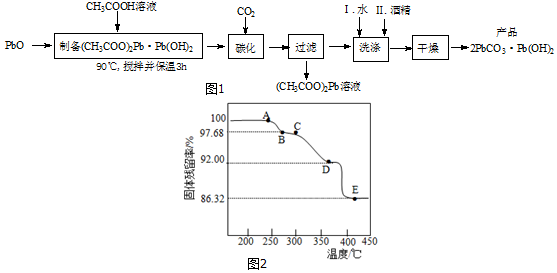
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发水分的方法使海水中的盐析出 | |
| B. | 用加热蒸馏的方法,从工业酒精中获得95.6%的乙醇 | |
| C. | 用加热升华的方法把单质碘从它和碘化钾固体形成的混合物中分离出来 | |
| D. | 用加热的方法,把掺杂在NaCl固体中的少量NH4HCO3固体除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
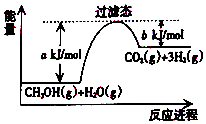 参考如图,按要求回答下列问题:
参考如图,按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com