
【题目】(1)如图进行实验,将a溶液逐渐加入盛b溶液的试管中,写出试管中观察到的现象及对应的离子方程式___。
a | b | 试管中现象 | 离子方程式 |
Na2CO3 | 稀盐酸 | ||
稀盐酸 | Na2CO3 |
(2)工业上利用NaIO3和NaHSO3反应来制取单质I2。配平下列化学方程式并用单线桥法表示电子转移的方向和数目:___。
NaIO3+NaHSO3=I2+Na2SO4+H2SO4+H2O
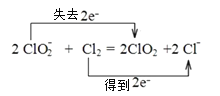
(3)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用双线桥法表示电子转移的方向和数目___。
【答案】
a | b | 试管中现象 | 离子方程式 |
Na2CO3 | 稀盐酸 | 立刻产生气泡 | CO32-+2H+=H2O+CO2↑ |
稀盐酸 | Na2CO3 | 开始时无气泡,后来有气泡 | CO32-+H+= HCO3-; HCO3-+H+=H2O+CO2↑ |
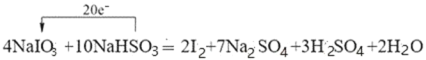
【解析】
(1)将碳酸钠逐滴加入到盐酸溶液中,盐酸过量,加入后碳酸钠立刻转化为二氧化碳,迅速产生气体;将盐酸逐滴加入碳酸钠溶液中,盐酸少量,碳酸钠转化为碳酸氢钠,开始无气体,随着盐酸加入的量增加,碳酸氢钠转化为二氧化碳、水和氯化钠,产生气体;
(2)NaIO3和NaHSO3反应来制取单质I2,碘元素由+5价变为0价,硫元素由+4价变为+6价,根据得失电子守恒,反应中转移20e-,据此配平化学方程式并用单线桥法表示电子转移的方向和数目;
(3)工业上可用Cl2氧化NaClO2溶液制取ClO2,氯气被还原为氯离子,ClO2-被氧化为ClO2,反应中转移电子数目为2e-,根据氧化还原反应中化合价升降相等书写离子反应方程式。
(1)将碳酸钠溶液滴入到稀盐酸中,盐酸过量,开始就产生气泡,其离子反应方程式为:CO32-+2H+=H2O+CO2↑;将稀盐酸滴入到碳酸钠溶液中,盐酸少量,开始时无气泡,后来产生气泡,其离子反应方程式为:CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑;
(2) NaIO3溶液中滴加少量NaHSO3溶液时,HSO3-被氧化成SO42,IO3-被还原成I2,根据电子守恒和元素守恒,该反应为:4NaIO3+10NaHSO3═2I2+7Na2SO4+3H2SO4+2H2O,该反应中转移的电子数为20e-,用单线桥法表示电子转移的方向和数目为: 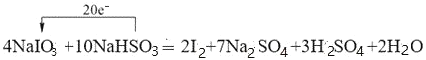 ;
;
(3)Cl2氧化NaClO2溶液制取ClO2,氯气本身被还原为氯离子,1个氯气分子反应得到2个电子,因此离子反应方程式为:2ClO2-+Cl2=2ClO2+2Cl-;双线桥法表示电子转移的方向和数目为: 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】分子式为C9H18O2的有机物A,在硫酸存在下与水反应生成B、C两种物质,C经一系列氧化最终可转化为B的同类物质,又知等质量的B、C的蒸气在同温同压下所占体积相同,则A的结构共有( )
A. 8种
B. 12种
C. 16种
D. 18种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.侯氏制碱法:NH3+CO2+H2O=![]() +
+ ![]()
B.小苏打溶液与稀硫酸混合:![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.向Ba(OH)2溶液中加少量NaHCO3: ![]() +Ba2++OH-=BaCO3↓+H2O
+Ba2++OH-=BaCO3↓+H2O
D.硫酸亚铁溶液与过氧化氢溶液混合:Fe2++2H2O2+4H+=Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基于临床研究,抗疟疾药物磷酸氯喹被证实在治疗新冠肺炎过程中具有疗效。4,7-二氯喹啉是合成磷酸氯喹的一种中间体,其结构简式如图所示。下列有关该物质的说法不正确的是
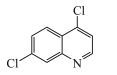
A.属于芳香族化合物B.分子中所有原子在同一平面上
C.分子式为C9H6NCl2D.可发生取代、加成、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中FeCl3的水解反应已达平衡:FeCl3+3H2O![]() Fe(OH)3+3HCl,若要使FeCl3的水解程度增大,应该采用的方法是
Fe(OH)3+3HCl,若要使FeCl3的水解程度增大,应该采用的方法是
A. 加入NaHCO3B. 加入AgNO3固体
C. 加入FeCl3固体D. 降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是s能级和p能级的电子云轮廓图,试回答问题。


(1)s电子云轮廓图呈________形,每个s能级有________个原子轨道;p电子云轮廓图呈________状,每个p能级有________个原子轨道,其能量关系为____________(填“相同”或“不相同”)。
(2)元素X的原子最外层的电子排布式为nsnpn+1,原子中能量最高的是________电子;元素X的名称是____,它的氢化物的电子式是________。
(3)若元素Y的原子最外层的电子排布式为nsn-1npn+1,那么Y的元素符号应为________,原子的电子排布图为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生活中或实验中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验原理:电极(______、______)、________、________、稀硫酸、耳机(或者电流计)。(请在空格中填写所缺的实验用品)
(3)实验装置(如图)。
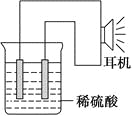
(4)原电池设计及注意的问题:
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓……”的声音。其原因是:在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的________极,电极反应是_____________________________,发生了________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A.4.6gNa完全转化成Na2O和Na2O2的混合物,生成物中阴离子总数为0.1NA
B.标准状况下,22.4L丙烷所含共用电子对数为8NA
C.标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA
D.常温下,1L0.1mol·L-1NH4NO3溶液中含有的NH4+数是0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类文明的发展历程,也是化学物质的发现和认识的历程。
(1)基态铁原子的价电子排布图为____。
(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,l个(SCN)2分子中含有![]() 键的数目为___。类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(HNCS)的沸点,其原因是________。
键的数目为___。类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(HNCS)的沸点,其原因是________。
(3)硝酸钾中NO3-的空间构型为______,写出与NO3-互为等电子体的一种非极性分子的化学式_____。
(4)钙的配合物离子[W(CO)5OH]-能催化固定CO2,该配合物离子中钨的配位数是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com