
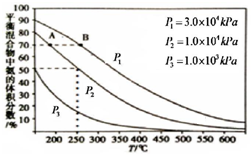
 目前工业合成氨的原理是:
目前工业合成氨的原理是:| 2x |
| 1-x+3-3x+2x |
| 2 |
| 3 |
| ||
| 3 |


科目:高中化学 来源: 题型:
| A、只有① | B、①② |
| C、②③④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑤ | B、①③⑥ | C、①③④ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、探究金属钠的性质只需应用实验法即可 | B、研究未知物质的性质可按照观察→实验→预测→结论的顺序进行 | C、科学家提出的假说一定能成为科学理论 | D、使用模型有助于人们研究物质的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25°C时,pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA | ||
| B、室温下,14.0g乙烯和丁烯的混合气体中含有的C-H键数目为2.0NA | ||
C、1L 0.5mol?L-1 的(NH4)2SO4溶液中含有的N
| ||
| D、标准状况下,22.4LCCl4中含有的共用电子对数目为4.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,30L pH=ll的Na2CO3溶液中含有的OH-数为0.03NA | B、用含有0.1mol FeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数等于0.1NA | C、25℃时,PH=13的1L Ba(OH)2溶液中含有的OH-数为0.2NA | D、100mL 12mol?L-1浓盐酸与足量MnO2加热反应,产生的氯气分子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源:2014秋北京市高一上学期期中化学试卷(解析版) 题型:选择题
将0.5L 1mol/L FeCl3溶液加水稀释至1L,所得溶液中氯离子的物质的量浓度是
A.3mol/L B.2mol/L C.1.5mol/L D.1mol/L
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江苏省高二(文)上学期期中化学试卷(解析版) 题型:选择题
在汽车尾气处理装置中加入适当的催化剂,能发生如下反应:4CO+2NO2 4CO2+N2。下列对该反应的说法中正确的是
4CO2+N2。下列对该反应的说法中正确的是
A.该反应是非氧化还原反应
B.该反应中氧化剂是CO、还原剂是NO2
C.该反应能减少汽车尾气对环境的污染
D.该反应生成14g N2时,转移2mole-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com