
| A. | 压强不再发生变化 | |
| B. | 平衡时A2、B2、AB的浓度之比是1:1:2 | |
| C. | 单位时间内生成nmol A2的同时生成nmol B2 | |
| D. | 单位时间内有n个A-A断裂的同时有2n 个A-B断裂 |
分析 可逆反应A2(g)+B2(g)?2AB(g)为气体体积不变的反应,该反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行解答.
解答 解:A.该反应为气体体积不变的反应,压强始终不变,不能根据压强判断平衡状态,故A错误;
B.平衡时A2、B2、AB的浓度之比是1:1:2,无法判断各组分的浓度是否不再变化,则无法判断是否达到平衡状态,故B错误;
C.单位时间内生成nmol A2的同时生成nmol B2,表示的都是逆反应速率,无法判断正逆反应速率是否相等,故C错误;
D.单位时间内有n个A-A断裂的同时有2n 个A-B断裂,表明正逆反应速率相等,该反应已经达到平衡状态,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,注意反应前后气体体积不变的反应,不能用压强判断平衡状态,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 25℃时,0.1mol/L pH=4.5的NaHC2O4溶液:c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | NaHCO3溶液:c(OH-)=c(H+)+c(H2CO3-)-c(CO32-) | |
| C. | 25℃时,pH=9、浓度均为0.1 mol/L的NH3•H2O、NH4Cl混合溶液:c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| D. | 0.1mol/L(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | y=1×a% | B. | y=1-1×a% | C. | y=1×a%=0.5 | D. | y=1-1×a%<0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④⑤ | C. | ①②③④⑤ | D. | 只有⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
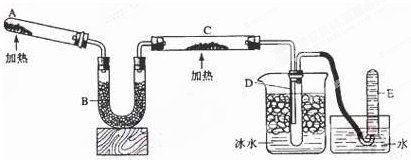
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验室用大理石与盐酸制取CO2 | B. |  制取SO2、检验SO2的漂白性 | ||
| C. | 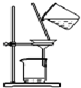 分离硫酸铜晶体 | D. | 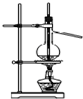 分离乙醇和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 溶液中的金属离子 | Fe2+ | Fe2+、Cu2+ | Cu2+、Fe3+ | |||
| 残留固体成分 | Fe、Cu | Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com