
【题目】某兴趣小组利用废旧电池的铜帽(铜锌总含量约99%)制备了CuSO4·5H2O样品,制备流程如下:
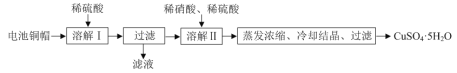
(1)“溶解Ⅱ”过程中,发生反应的离子方程式为___。
(2)“溶解Ⅱ”过程中应控制反应温度,温度不能过高的原因是___。
(3)为测定所得CuSO4·5H2O样品的纯度,兴趣小组进行了如下实验:称取2.540g样品,配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量KI并充分振荡后,滴加几滴淀粉溶液,再滴入0.0400mol·L-1的Na2S2O3溶液至刚好完全反应,恰好完全反应时消耗Na2S2O3溶液的体积为25.00 mL。实验过程中发生的反应如下:2Cu2++4I-=2CuI↓+I2、2S2O32-+I2=S4O62-+2I-
①配制250mL溶液所需的玻璃仪器除烧杯、胶头滴管外还有___。
②计算出样品中CuSO4·5H2O的质量分数。___(写出计算过程)
【答案】3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 防止硝酸挥发及分解 250mL容量瓶、玻璃棒 98.43%
【解析】
废弃旧电池的铜帽用稀硫酸其中的Zn,经过滤后得到不溶于酸的Cu,再用稀硫酸和稀硝酸溶解Cu,因硝酸具有强氧化性,能在酸性条件下氧化铜生成铜盐,将所得硫酸铜溶液加热蒸发浓缩,再冷却结晶,最后过滤、洗涤即可获得CuSO4·5H2O;
(1)“溶解Ⅱ”过程中是Cu溶解于稀硝酸生成硝酸铜、NO和水;
(2)硝酸具有挥发性,且不稳定;
(3)①根据配制一定物质的量浓度的溶液操作步骤判断需要的玻璃仪器;
②已知:2Cu2++4I-═2CuI(白色)↓+I2,2S2O32-+I2═2I-+S4O62-,得关系式2CuSO4·5H2O~2Cu2+~I2~2S2O32-,结合滴定时消耗的Na2S2O3溶液体积,计算参加反应的Na2S2O3的物质的量,再计算出CuSO4·5H2O的物质的量,最后计算样品的质量分数。
(1)“溶解Ⅱ”过程中是Cu溶解于稀硝酸生成硝酸铜、NO和水,发生反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)硝酸具有挥发性,且不稳定,受热易分解,故“溶解Ⅱ”过程中应控制反应温度,温度不能过高,以防止硝酸分解和挥发,提高硝酸的利用率,
故答案为:防止硝酸挥发及分解;
(3)①配制250mL溶液的主要操作步骤是称量、溶解、转移、洗涤、定容及摇匀,所需玻璃仪器依次是烧杯、玻璃棒、250mL容量瓶、胶头滴管等,则还需要玻璃棒、250mL容量瓶,
故答案为:250mL容量瓶、玻璃棒;
②n(Na2S2O3)=0.02500L×0.04000mol·L1=1.000×103mol,
根据关系式2Cu2+~I2~2S2O32-,
n(CuSO4)=n(Na2S2O3)=1.000×103mol,
250mL溶液中n(CuSO4)=![]() ×1.000×103mol=1.000×102mol,
×1.000×103mol=1.000×102mol,
m(CuSO4·5H2O)=1.000×102mol×250g·mol1=2.500g,
样品中CuSO4·5H2O的质量分数为![]() ×100%=98.43%。
×100%=98.43%。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
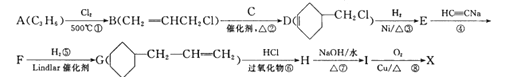
【题目】A是石油裂解气的主要成分之一,以A为原料制备药物中间体X的合成路线如下:
已知i.
ii.![]() 。
。
回答下列同题:
(1)A的结构简式为_________,B的名称为__________,D中含有的官能团的名称是___________。
(2)有机物I的结构简式为___________;反应④的反应类型是___________。
(3)由A生成B的化学方程式为______________________________________。
(4)反应⑧的化学方程式为___________________________________________。
(5)满足以下条件的X的同分异构体有___________种。
i.能发生银镜反应;
ii.含有六元环结构;
iii.六元环上有2个取代基。
其中核磁共振氢谱中有6组峰,且峰面积之比为4:4:3:2:2:1的有机物的结构简式为________(任写一种)。
(6)参照F的合成路线,以CH3CH=CHCH3为原料设计制备 的合成路线:__________(其他试剂任选)。
的合成路线:__________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1 mol CO2中含有________mol C和________mol O;
(2)1.80 mol CO2中含有________个CO2分子,________个C原子,________个O原子;
(3)3.60 mol CO2中所含CO2分子数与________个H2O分子数目相等,8.40×1026个O3分子的物质的量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在处理废水时某反应体系中有6种粒子:N2、HCO3-、ClO-、CNO-、H2O、Cl-,在反应过程中部分离子浓度与反应进程关系如图所示。下列有关该反应的说法正确的是( )

A. 在上述反应体系中,CNO-是氧化剂
B. 还原产物与氧化产物的物质的量之比为1∶3
C. 在标准状况下,产生4.48 L N2时转移0.8 mol电子
D. 上述反应中,只有两种元素化合价发生了变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近在-100 ℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键)。下列说法正确的是
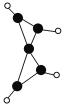
A. X既能使溴的四氯化碳溶液褪色,又能使酸性KMnO4溶液褪色
B. X是一种常温下能稳定存在的液态烃
C. X和戊烷类似,容易发生取代反应
D. 充分燃烧等质量的X和甲烷,甲烷消耗氧气较多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)2,3—二乙基—1,3—戊二烯用H2完全加成后产物的名称:_________________________
(2)组成为C3H6Br2的卤代烃,同分异构体有_________种
(3)碳原子数小于10的烷烃中,一氯取代物没有同分异构体的烷烃共有_________种
(4)C4H10O的同分异构体中,属于醇类且含有“手性碳原子”的结构简式为__________。
(5)实验室制取乙炔的化学方程式:_______________________________________
(6)2—甲基—1,3—丁二烯加聚反应方程式:________________________________
(7)甲苯制取TNT的化学方程式:____________________________________________
(8)等物质的量的甲烷、乙烯、乙炔、苯等四种有机物分别完全燃烧,需要O2最多的是__;等质量的上述四种物质分别完全燃烧,需要O2最多的是____。
(9)写出间甲基苯乙烯的结构简式______________________________;
(10)与H2加成生成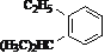 的炔烃的结构简式____________;
的炔烃的结构简式____________;
(11)写出4-甲基-2-乙基-1-戊烯的键线式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
![]()
下列说法不正确的是![]()
![]()
A. 反应①中![]() 是氧化剂
是氧化剂
B. 两个反应中硫元素均被氧化
C. 氧化性:![]()
D. 反应①、②中生成等量的![]() 时转移电子数之比为1:5
时转移电子数之比为1:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料制备二草酸铬钾的实验步骤如图:

回答下列问题:
(1)“熔融”的装置如图,坩埚W的材质可以是___(填“铁”“陶瓷”或“玻璃”);FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为____。

(2)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl及NaFeO2等,步骤①的具体步骤为水浸,过滤,调pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为_____。
(3)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为____。
(4)由步骤③可知,溶解度:Na2Cr2O7____(填“>”“<”或“══”)K2Cr2O7。
(5)步骤④包含的具体操作有___、___过滤并洗涤,经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示)

(6)步骤⑤需往两种固体混合物中加入一滴水及少量酒精研磨,所用的硅酸盐质仪器的名称是____。
(7)采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数,将样品加热到80°C时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O晶体中n=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com