
【题目】溴、铜及其化合物用途非常广泛。回答下列问题:
(1)基态Br原子核外电子排布式为[Ar]___。
(2)已知反应:Cu(BF4)2.6H2O+Cu+8CH3CN=2[Cu(CH3CN)4]BF4+6H2O。
①配合物[Cu(CH3CN)4]BF4中,与铜形成配位键的原子是___,BF4-的空间构型是___,与BF4-互为等电子体的分子有___(任写一种)。
②CH3CN分子中碳原子的杂化方式是___;1个CH3CN分子中含有___个σ键。
(3)电子亲合能与电离能相对应,元素的气态基态原子获得一个电子成为气态一价负离子所释放的能量称为该元素的第一电子亲合能,其大小主要取决于原子的有效核电荷、原子半径和原子的电子构型等因素。Br与F、Cl位于同一主族,第一电子亲合能(如图1所示)原比氯和溴都小,其原因是___。
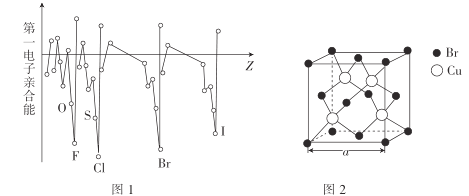
(4)溴化亚铜(晶胞结构如图2所示)可用作有机合成的催化剂,密度为4.71g·cm-3。
①晶胞中Br-的配位数为___。
②晶胞参数a=___(列出表达式即可)nm。(设NA为阿伏加德罗常数的数值)
【答案】3d104s24p5 N 正四面体 CCl4(或SiF4等) sp3和sp 5 氟元素的原子半径非常小,电子云拥挤,电子间的相互排斥力很大,导致原元素的第一电子亲合能减小 4 
【解析】
(1)溴是35号元素,根据构造原理写出核外电子排布式;
(2)①配位化合物的形式是一方提供空轨道,另一方提供孤电子对。配体CH3CN 中N原子可提供孤电子对;判断空间构型时可利用价层电子对互斥理论。BF4-中无孤电子对,有4个σ键电子对,故呈四面体形;寻找等电子体时可利用价电子迁移法找到。
②可根据碳原子的成键方式来判断杂化类型,饱和碳原子为sp3杂化,三键碳原子为sp杂化;
(3) F原子的半径小,根据电子间排斥大,回答该题;
(4)②CuBr晶胞中含有4个Cu和4个Br,根据晶体的密度 ,
,![]() ,求算a,注意单位。
,求算a,注意单位。
(1)溴是35号元素,核外电子排布式为[Ar] 3d104s24p5;
(2)①配合物的形成中,需要有金属离子提供空轨道,配体提供孤电子对,配体CH3CN中能提供孤电子对的是N,则配为原子是N。BF4-,中心原子B的价层电子对数为![]() ,还有4对共用电子对,不含孤对电子对,则空间构型为正四面体形;将BF4-中所带的负电荷迁移给B,转化为C或Si,将F替换为同族元素Cl,可找到等电子体CCl4或SiF4;
,还有4对共用电子对,不含孤对电子对,则空间构型为正四面体形;将BF4-中所带的负电荷迁移给B,转化为C或Si,将F替换为同族元素Cl,可找到等电子体CCl4或SiF4;
②配体CH3CN中,甲基上的碳为饱和的碳原子,杂化为sp3杂化,-CN中含有三键,碳原子是sp杂化;CH3CN中含有3个C-H,1个C-C,和1个C≡N,所有的单键均为σ键,三键中有1个σ键,则一共有4+1=5个σ键;
(3)同主族元素中F原子的半径最小,且电负性最大,吸引电离能力强,被吸引的电子距离原子核近,与F原子自身的电子的排斥较大,造成第一电子亲合能减小;
(4) 溴化亚铜晶胞中,4个Cu均为该晶胞所有,8个顶点的Br分别为8个晶胞所有,6个面心的Br分别为2个晶胞所有,则1个晶胞中含有![]() ,可知化学式为CuBr;
,可知化学式为CuBr;
①根据图示,与Cu相连的Br有4个,Cu的配位数4,根据化学式CuBr,可知Br的配位数也是4;
②晶体的密度 计算,CuBr的摩尔质量为144g·mol-1,
计算,CuBr的摩尔质量为144g·mol-1,![]() ,转化单位,
,转化单位,![]() ,带入数据,
,带入数据,![]() ,可得a=
,可得a= nm。
nm。


科目:高中化学 来源: 题型:
【题目】生物浸出是用细菌等微生物从固体中浸出金属离子,有速率快、浸出率高等特点。氧化亚铁硫杆菌是一类在酸性环境中加速 Fe2+氧化的细菌,培养后能提供 Fe3+, 控制反应条件可达细菌的最大活性,其生物浸矿机理如下图。
![]()
反应1 反应2
(1)氧化亚铁硫杆菌生物浸出 ZnS 矿。
①反应 2 中有 S 单质生成,离子方程式是__。
② 实验表明温度较高或酸性过强时金属离子的浸出率均偏低,原因可能是__。
(2)氧化亚铁硫杆菌生物浸出废旧锂离子电池中钴酸锂(LiCoO2)与上述浸出机理相似,发生反应1 和反应3:LiCoO2 +3Fe3+=Li++ Co2++3Fe2++O2↑
①在酸性环境中,LiCoO2 浸出 Co2+的总反应的离子方程式是__。
②研究表明氧化亚铁硫杆菌存在时,Ag+对钴浸出率有影响,实验研究 Ag+的作用。取 LiCoO2 粉末和氧化亚铁硫杆菌溶液于锥形瓶中,分别加入不同浓度 Ag+的溶液,钴浸出率(图 1)和溶液 pH(图 2)随时间变化曲线如下:
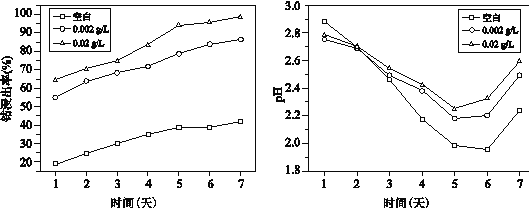
图1 不同浓度Ag+作用下钴浸出率变化曲线 图2 不同浓度Ag+作用下溶液中pH变化曲线
Ⅰ.由图 1 和其他实验可知,Ag+能催化浸出 Co2+,图 1 中的证据是__。
Ⅱ.Ag+是反应 3 的催化剂,催化过程可表示为: 反应 4:Ag++LiCoO2=AgCoO2+Li+
反应 5:……
反应 5 的离子方程式是__。
Ⅲ.由图 2 可知,第 3 天至第 7 天,加入 Ag+后的 pH 均比未加时大,结合反应解释其原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,纳和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() Na2CO3+C。下列说法错误的是( )
Na2CO3+C。下列说法错误的是( )
A.放电时,ClO4-向负极移动
B.放电时,Na+向正极移动
C.放电时,正极反应为:3CO2+3e-=2CO32-+C
D.放电时,正极反应为:Na++e-=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积固定的密闭容器中发生反应:![]() 。下列叙述中不能说明上述反应已达到化学平衡状态的是
。下列叙述中不能说明上述反应已达到化学平衡状态的是
A.混合气体的密度不变
B.体系的压强不变
C.混合气体的平均相对分子质量不变
D.反应体系中乙醇的物质的量浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监察局常用“定电位NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示。下列说法不正确的是( )

A.“对电极”是负极
B.“工作电极”上发生的电极反应为NO2+2e-+2H+=NO+H2O
C.传感器工作时H+移向“对电极”
D.“对电极”的材料可能为活泼金属锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制备纯硅反应的热化学方程式:SiCl4(g)+2H2(g)=Si(s)+ 4HCl(g)△H=QkJmol-1(Q>0)。在一定某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应,下列叙述错误的是
A.反应过程中,若充入一定量NH3,可能提高SiCl4的转化率
B.若反应开始时加入1mol SiCl4,则达到平衡时,.吸收热量小于Q kJ
C.反应至4min时,若HCl浓度为0.12 molL-l,H2的反应速率为0.03 molL-1min-1
D.当反应吸收热量为0.025QkJ时,生成的 HC1 恰好中和 0.l molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金ThNi5可催化反应CO(g)+3H2(g)=CH4(g)+H2O(g),在一定温度下,反应过程中有无催化剂的能量变化如图。下列叙述正确的是

A.使用催化剂时反应的速率主要决定于第②步
B.缩小体积可加快该反应速率,是因为增大了活化分子百分数
C.使用催化剂降低反应的焓变,降低温度有利于产物的生成
D.升高温度,平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物邻二乙烯苯广泛用于制造离子交换树脂,其结构简式为![]() ,下列关于邻二乙烯苯的说法正确的是( )
,下列关于邻二乙烯苯的说法正确的是( )
A.1mol 邻二乙烯苯含有5 mol碳碳双键
B.所有的原子不可能在同一平面
C.能发生加成反应,也能发生取代反应,不能发生聚合反应
D.苯环上的二氯取代物有4种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示转化关系判断下列说法正确的是( )
![]()
A.(C6H10O5)n可以是淀粉或纤维素,二者均属于多糖,互为同分异构体
B.可以利用与新制Cu(OH)2悬浊液反应生成砖红色沉淀证明反应①的最终产物为葡萄糖
C.酸性高锰酸钾溶液可将乙醇氧化为乙酸,将烧黑的铜丝趁热插入乙醇中也可得到乙酸
D.向反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com