
分析 (1)根据n=$\frac{m}{M}$计算过氧化钠的物质的量,根据反应2Na2O2+2H2O═4NaOH+O2↑计算氧气物质的量,再根据V=nVm计算氧气体积;
(2)根据钠离子守恒计算n(NaOH),再根据c=$\frac{n}{V}$计算NaOH溶液物质的量浓度.
解答 解:(1)过氧化钠的摩尔质量为78g/mol,则n(Na2O2)=$\frac{7.8g}{78g/mol}$0.1mol,
由2Na2O2+2H2O═4NaOH+O2↑可知生成氧气的物质的量为:n(O2)=$\frac{1}{2}$n(Na2O2)=0.05mol,标况下V(O2)=0.05 mol×22.4L/mol=1.12L,
答:标况下生成气体的体积为1.12L;
(2)根据钠离子守恒n(NaOH)=2n(Na2O2)=0.2mol,
所得溶液中氢氧化钠溶液物质的量浓度为:$\frac{0.2mol}{1L}$=0.2mol/L,
答:所得溶液的物质的量浓度为0.2mol/L.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能在水溶液电离出H+的物质是酸 | |
| B. | 氧化还原反应中所有元素的化合价均有升降 | |
| C. | 在化学反应中,得电子越多的氧化剂,其氧化性就越强 | |
| D. | 氧化还原反应的实质是电子的转移(得失或偏移) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸的物质的量浓度为1.84mol/L | |
| B. | 稀释该硫酸时,应将蒸馏水沿玻璃棒缓慢注入其中 | |
| C. | 配制200mL4.6mol•L-1的稀硫酸需取该硫酸50.0mL | |
| D. | 常温下,5.6gFe与足量的稀硫酸反应转移电子的物质的量为0.3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

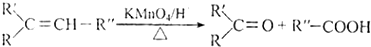
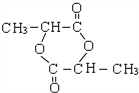
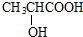 +HBr$\stackrel{△}{→}$CH3CHBrCOOH+H2O
+HBr$\stackrel{△}{→}$CH3CHBrCOOH+H2O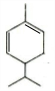 ,A与等物质的量的Br2进行加成反应的产物共有3种.(不考虑立体异构)
,A与等物质的量的Br2进行加成反应的产物共有3种.(不考虑立体异构)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的球棍模型: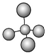 | B. | NH4Br的电子式: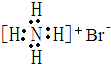 | ||
| C. | 34S2-的结构示意图: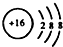 | D. | 邻羟基甲苯酸的结构简式: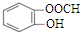 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com