
【题目】脱硫废水的主要超标项目为悬浮物、重金属阳离子(Hg2+、Cu2+等)、SO42-。某工厂采用如下流程进行脱硫废水处理。其中助凝剂为聚丙烯酰胺![]()
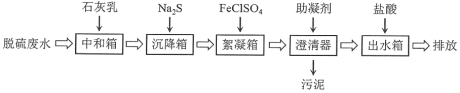
下列说法不正确的是
A.该方案用石灰乳仅用来调节pH使大部分重金属阳离子形成氢氧化物沉淀
B.加入Na2S可以将进入沉降箱的Hg2+,Cu2+转化为硫化物沉淀
C.加入FeClSO4是利用Fe3+易水解的性质,形成胶体吸附悬浮物
D.助凝剂聚丙烯酰胺是加成聚合反应的产物
科目:高中化学 来源: 题型:
【题目】锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下:

(1)1mol焦炭在过程Ⅰ中失去____mol电子。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为________。
(3)步骤(2)中的电解过程中,若用甲醇燃料电池作电源,用KOH作电解质,负极反应为_________。
(4)整过生产过程必须严格控制无水,回答下列问题:
①SiCl4遇水剧烈水解生成SiO2和一种酸,化学反应方程式为_________。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是_________。
(5)Zn还原SiCl4的可逆反应如下:
SiCl4(g)+2Zn(s)![]() Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
A.还原过程需在无氧的气氛中进行 |
B.投入1molZn可生成14g还原产物 |
C.增加SiCl4(g)的量,该反应平衡常数不变 |
D.若SiCl4(g)过量可增大△H的值 |
(6)有一种由硅制作的材料中常加入Ag2SO4 ,已知某温度下Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ag2SO4的Ksp=_______(两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F(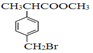 )是合成某种药物的中间体,它的一种合成路线如下:
)是合成某种药物的中间体,它的一种合成路线如下:
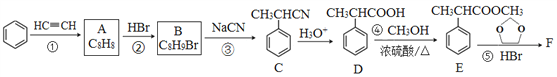
回答下列问题:
(1)A的结构简式为______,分子中处于同一平面的原子最多有____个。
(2)E中官能团名称是_____,①~④中属于加成反应的是_______(填序号)。
(3)反应③的化学方程式为______________。
(4)反应⑤的生成物有两种,除了F以外,另一种生成物的名称是______。
(5)满足下列条件的D的同分异构体有______种。
①能与FeCl3溶液发生显色反应; ②能发生银镜反应; ③分子中有1个甲基
(6)仿照E的合成路线,设计一种由![]() 合成
合成![]() 的合成路线_________________。
的合成路线_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
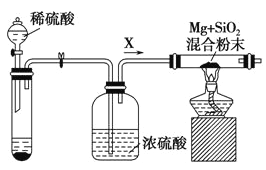
(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
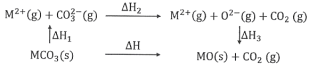
下列说法正确的是
A.△H1(CaCO3)>△H1(MgCO3)>0
B.△H2(MgCO3)>△H2(CaCO3)>0
C.△H1(CaCO3)-△H1(MgCO3)=△H3(CaO)-△H3(MgO)
D.对于MgCO3和CaCO3,△H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一铁的氧化物样品,用140 mL 5 mol·L-1的盐酸恰好完全溶解,所得溶液还能与通入的0.56 L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为
A.Fe2O3B.Fe3O4C.Fe4O5D.Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
B.向碳酸氢铵溶液中加入过量的NaOH溶液:NH4++OH-=NH3·H2O
C.向明矾溶液中加入Ba(OH) 2溶液至生成沉淀的物质的量最多:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
D.等体积、等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(![]() ),是一种高效消毒剂,它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下
),是一种高效消毒剂,它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下

①在三颈烧瓶中加入一定量冰醋酸与浓硫酸的混合物,再缓缓加入适量30%的双氧水;
②不断搅拌并控制装置B中混合液的温度为20~30℃至反应结束;
③接入仪器C和抽气泵,在锥形瓶中收集得到产品。
回答下列问题:
(1)仪器C的名称是_______,仪器C中冷水流入口是_______ (填“a”或“b”)。
(2)为更好地控制反应温度,应采用的加热方法是______________。
(3)生成过氧乙酸的化学方程式为_________________。
(4)实验测得产物过氧乙酸的百分含量随反应物比例和反应时间的变化数据如下表。由表中数据可知,反应物最佳比例(CH3COOH/H2O2)是_______,最佳反应时间约_______。

(5)产品中过氧乙酸浓度的测定:取2.00mL过氧乙酸产品试样,加水稀释成100mL;从中取出5.00mL,逐滴滴加酸性KMnO4溶液至溶液恰好呈粉红色,以除去残余的H2O2;再加入稍过量的KI溶液,发生反应CH3COOOH+2I-+2H+=I2+CH3COOH+H2O;反应完全后,滴入几滴淀粉溶液,用0.1000mol·L-1的Na2S2O3标准液滴定至终点(反应式为2S2O32-+I2=S4O62-+2I-),消耗14.30mLNa2S2O3标准液。则产品中过氧乙酸的物质的量浓度是________mol·L-1 (保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸锌晶体是一种微溶于水的白色粉末,可用于制纳米氧化锌、照相乳剂等。以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料生产草酸锌晶体(ZnC2O4·2H2O)的流程如下:

下列说法不正确的是( )
A.滤渣A、滤渣B的主要成分分别为SiO2和Fe(OH)3
B.“除锰”时发生的离子反应为Mn2++H2O2+H2O=MnO(OH)2↓+2H+
C.流程中“除铁”与“除铜”顺序可以颠倒
D.“合成”时过滤所得滤液主要溶质为NH4Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com