
| A、3.5 | B、3.8 |
| C、2.5 | D、4.2 |
| 1000ρw |
| M |
| 1000×1.19×37% |
| 36.5 |


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
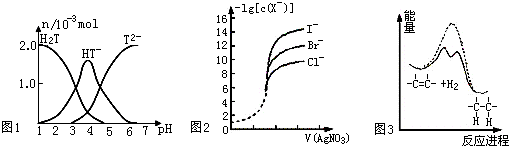
| A、常温下,向20mL0.1mol?L-1酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图1,则当VNaOH=10mL时,溶液中存在2C(Na+)=C(H2T)+C(HT-)+C(T2-) | ||
| B、用0.0100mol?L-1硝酸银标准溶液,滴定浓度均为0.100mol?L-1的 Cl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl- | ||
C、已知25℃、101kPa时:①2Na(s)+
| ||
| D、由图3可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 名称 | 洗涤灵 | 洁厕灵 | 炉具清洁剂 | 污渍爆炸盐 | 漂白粉 |
| 产品样式 |  |  |  |  |  |
| 有效成分 或功能 | 清洗油污 | 盐酸 | 氢氧化钠 | 过碳酸钠 | 消毒 |

| 实验步骤 | 实验现象 | 实验结论 |
| 把少量漂白粉样品加入水中,通入足量的CO2气体, | 漂白粉的漂白作用已完全失效. |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com