
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,y的转化率为75% |
| B、反应可表示为X+3Y?2Z,其平衡常数为1600 |
| C、增大压强使平衡向生成Z的方向移动,平衡常数不变 |
| D、改变温度但不可以改变此反应的平衡常数 |
| 消耗量 |
| 起始量 |
| 0.2mol/L-0.05mol/L |
| 0.2mol/L |
| c2(Z) |
| c(X)c3(Y) |
| (0.1mol/L)2 |
| (0.05mol/L)×(0.05mol/L)3 |


科目:高中化学 来源: 题型:
A、Cu
| ||||||
B、Cu
| ||||||
C、Cu
| ||||||
D、Cu
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9.6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
| A、实验①中硝酸只和铁粉反应 |
| B、原混合物总质量为105.6g |
| C、硝酸浓度为4mol?L-1 |
| D、V=6720 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.50mol |
| B、0.19mol |
| C、0.25mol |
| D、0.31mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
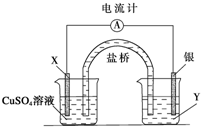 根据下列氧化还原反应2FeCl3+Cu═2FeCl2+CuCl2设计一个原电池:
根据下列氧化还原反应2FeCl3+Cu═2FeCl2+CuCl2设计一个原电池:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、前2s以N2O4的浓度变化表示的反应速率为0.01mol/(L?s) |
| B、在2s时体系内的压强为开始时的1.1倍 |
| C、在平衡时体系内含N2O4 0.25mol |
| D、平衡时,N2O4的转化率为40% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 500 | 1000 |
| C(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
| 实验编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、44.8 g固体物质为Na2CO3 |
| B、44.8 g固体物质为NaOH和Na2O2混合物 |
| C、44.8 g固体物质为0.2 mol NaOH和0.4 mol Na2CO3混合物 |
| D、44.8 g固体物质为0.2 mol NaOH、0.2 mol Na2CO3、0.2 mol Na2O2混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com