
下列实验所对应的离子方程式正确的是()
A. 向NaAlO2溶液中通入少量CO2:AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3﹣
B. 向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O═Fe(OH)3↓+3H+
C. 在碳酸氢钡溶液中加入过量的氢氧化钠溶液:Ba2++2HCO3﹣+2OH﹣═BaCO3↓+CO32﹣+2H2O
D. 向FeCl2溶液中加入少量K3[Fe(CN)6]溶液:4Fe2++2[Fe(CN)6]4﹣═Fe4[Fe(CN)6]2↓
考点: 离子方程式的书写.
专题: 离子反应专题.
分析: A.碳酸氢根离子酸性大于氢氧化铝,反应生成碳酸根离子,不是碳酸氢根离子;
B.反应生成氢氧化铁胶体,不是氢氧化铁沉淀;
C.氢氧化钠过量,离子方程式按照碳酸氢钡的组成书写,反应才碳酸钡沉淀、碳酸根离子和水;
D.K3[Fe(CN)6]中[Fe(CN)6]3﹣离子带有3个单位负电荷.
解答: 解:A.向NaAlO2溶液中通入少量CO2,反应生成氢氧化铝沉淀和碳酸根离子,正确的离子方程式为:2AlO2﹣+CO2+3H2O═2Al(OH)3↓+CO32﹣,故A错误;
B.向沸水中滴加饱和的氯化铁溶液,反应生成氢氧化铁胶体,正确的离子方程式为:Fe3++3H2O Fe(OH)3(胶体)+3H+,故B错误;
Fe(OH)3(胶体)+3H+,故B错误;
C.在碳酸氢钡溶液中加入过量的氢氧化钠溶液,反应生成碳酸钡、碳酸钠和水,反应的离子方程式为:Ba2++2HCO3﹣+2OH﹣═BaCO3↓+CO32﹣+2H2O,故C正确;
D.含Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀,[Fe(CN)6]3﹣离子带有3个单位负电荷,正确的离子方程式为:3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓,故D错误;
故选C.
点评: 本题考查了离子方程式的正误判断,为2015届高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;选项D为易错点,注意K3[Fe(CN)6]电离出的是[Fe(CN)6]3﹣离子.


科目:高中化学 来源: 题型:
下列关于水的说法正确的是( )
|
| A. | 我们平时应多饮用很纯净的水,防止有毒物质进入体内 |
|
| B. | 所有天然水都不能饮用 |
|
| C. | 人体内含有约 |
|
| D. | 人类可利用的水只占自然界的水极少量,我们应节约用水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于如图所示的原电池,下列说法正确的是()
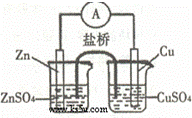
A. 电子从锌电极通过检流计流向铜电极
B. 盐桥中的阴离子向硫酸铜溶液中迁移
C. 锌电极发生还原反应,铜电极发生氧化反应
D. 铜电极上发生的电极反应是2H++2e﹣=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
向5mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度大小关系为.
查看答案和解析>>
科目:高中化学 来源: 题型:
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)⇌CuS(s)+Mn2+(aq),下列说法错误的是()
A. 相同条件下,MnS的Ksp比CuS的Ksp大
B. 该反应的平衡常数K=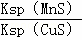
C. 该反应达到平衡时c(Mn2+)=c(Cu2+)
D. 往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是 ( )
A.乙烯和苯都能使溴水褪色,褪色的原因相同
B.淀粉、油脂、蛋白质都能水解,但水解产物不同
C.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D.乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
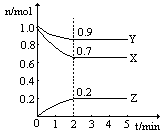 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为 ;
(2)从开始至2min,Z的平均反应速率为 ;
(3)若X、Y、Z均为气体,反应达平衡时:
①此时体系的压强是开始时的 倍;
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应为 反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时 (填增大、减小或相等)。
(4)此反应达平衡后,若只加大体系压强,Z的物质的量减少,若Y是气体,则X的聚集状态是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
A. 元素的单质可由氧化或还原含该元素的化合物来制得
B. 得电子越多的氧化剂,其氧化性越强
C. 阳离子只能得到电子被还原,只能作氧化剂
D. 含有最高价元素的化合物一定具有强氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com