
【题目】根据下列实验现象,所得结论错误的是( )

A.AB.BC.CD.D
【答案】B
【解析】
![]() 根据原电池的工作原理,左烧杯中铁表面有气泡,说明负极为铝,正极为铁,金属活动性
根据原电池的工作原理,左烧杯中铁表面有气泡,说明负极为铝,正极为铁,金属活动性![]() ,右边烧杯中铜表面有气泡,说明铁为负极,铜为正极,金属活动性
,右边烧杯中铜表面有气泡,说明铁为负极,铜为正极,金属活动性![]() ,则活动性为
,则活动性为![]() ,故A正确;
,故A正确;
B.Cu与浓硝酸反应,反应中的化合价变化为:![]() 中N元素由
中N元素由![]() 价降低为
价降低为![]() 中N元素
中N元素![]() 价,
价,![]() 是氧化剂,
是氧化剂,![]() 是还原产物,方程式为:
是还原产物,方程式为:![]() ;生成的红棕色二氧化氮和水发生氧化还原反应,
;生成的红棕色二氧化氮和水发生氧化还原反应,![]() ,所以图中试管中收集到无色气体为一氧化氮,但不是铜和浓硝酸反应生成一氧化氮,故B错误;
,所以图中试管中收集到无色气体为一氧化氮,但不是铜和浓硝酸反应生成一氧化氮,故B错误;
C.![]() 遇
遇![]() 发生反应
发生反应![]() ,
,![]() 为血红色,增大氯化铁溶液的浓度,根据溶液颜色变化来判断反应方向,如果溶液颜色加深,则说明平衡向正反应方向移动,所以能达到实验目的,故C正确;
为血红色,增大氯化铁溶液的浓度,根据溶液颜色变化来判断反应方向,如果溶液颜色加深,则说明平衡向正反应方向移动,所以能达到实验目的,故C正确;
D.该装置的气密性检查,主要是通过气体压强增大看体积变化来进行检验,夹紧止水夹,向长颈漏斗中加水至其液面高于烧瓶内的液面,一段时间后,看液面高度差有无变化,变化说明装置漏气,反之不漏气,故D正确;
故选 B.


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】在相同的A、B密闭容器中分别充入2 mol SO2和1 mol O2,使它们在一定温度下反应,并达新平衡:2SO2+O2![]() 2SO3(g)。若A容器保持体积不变,B容器保持压强不变。当A中SO2的转化率为25%时,B中SO2的转化率为
2SO3(g)。若A容器保持体积不变,B容器保持压强不变。当A中SO2的转化率为25%时,B中SO2的转化率为
A. 25%B. 大于25%
C. 小于25%D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度和体积下,对反应![]()
![]()
![]() 进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
物质的量 |
|
|
|
|
甲 | amol | amol | 0mol | 0mol |
乙 | 2amol | amol | 0mol | 0mol |
丙 | 0mol | 0mol | amol | amol |
丁 | amol | 0mol | amol | amol |
上述四种情况达到平衡后,![]() 最大的是
最大的是![]()
A.甲B.乙C.丙D.丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、NO是大气污染物,NH4NO3、H2SO4等是水体污染物,有效去除这些污染物是一项重要课题。
(1) NO、SO2可以先氧化,后用碱吸收。其氧化过程的反应原理如下:
NO(g)+O3(g)NO2(g)+O2(g);ΔH1=-200.9 kJ·mol-1
SO2(g)+O3(g)SO3(g)+O2(g);ΔH2=-241.6 kJ·mol-1
2SO2(g)+O2(g)2SO3(g);ΔH3=-196.6 kJ·mol-1
则反应2NO2(g)2NO(g)+O2(g)的ΔH= ________kJ·mol-1。
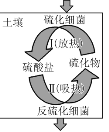
(2) 土壤中的硫循环如图所示,土壤中的黄铁矿(FeS2)在过程Ⅰ中会转化成硫酸亚铁和硫酸,该过程发生的化学方程式为________;某种反硫化细菌在过程Ⅱ中需要有乳酸参与反应消耗硫酸,生成H2S并伴有热量放出,那么乳酸除在反应中作还原剂外,还存在另一作用并解释原因:________。
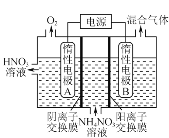
(3) 电解法除去工业废水中的硝酸铵的装置示意图如图所示,阴极电极反应式为_______。
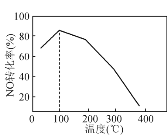
(4) 向恒容密闭容器中充入1 mol NO和2 mol O3,发生如下反应:NO(g)+O3(g)NO2(g)+O2(g);ΔH<0。不同温度下反应相同时间后,体系中NO转化率随温度变化曲线如图。温度低于100 ℃时,NO转化率随温度升高而增大的主要原因是________;当温度高时,O3分解生成活性极高的氧原子,NO转化率随温度升高而降低,可能的原因有:①________,②________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将 0.4 mol A(g)和 0.2 mol B (g)充入 10 L 的恒容密闭容器发生反应:2A(g)+B(g)xC(g)(x是化学计量数),达平衡时测得 C(g) 的浓度为 0.016mol/L,B(g)的物质的量为0.12mol。下列说法中不正确的是
A.x=2
B.达平衡时A的转化率为40%
C.该温度下该反应的化学平衡常数是K=12
D.反应前容器内的压强与平衡后容器内的压强之比为15:13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料。以![]() 和
和![]() 为原料合成氨气
为原料合成氨气![]() 。取一定量的
。取一定量的![]() 和
和![]() 置于密闭容器中进行反应。已知化学平衡常数K与温度的关系如表:
置于密闭容器中进行反应。已知化学平衡常数K与温度的关系如表:
| 200 | 300 | 400 |
K |
|
|
|
(1)写出该反应的平衡常数表达式______。
(2)K1和![]() 比较:
比较:![]() ______
______![]() 填写“
填写“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]()
(3)在![]() 时该反应进行一段时间后,测定
时该反应进行一段时间后,测定![]() 、
、![]() 和
和 ![]() 的物质的量分别为2mol、1mol和2mol,则此时反应速率
的物质的量分别为2mol、1mol和2mol,则此时反应速率![]() ______
______![]() 。
。 ![]() 填写“
填写“![]() ”、“
”、“![]() ”、“
”、“![]() ”或“不能确定”
”或“不能确定”![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氨气、空气为主要原料制硝酸。
(1)氨气被氧气催化氧化生成NO的化学方程式是______。
(2)在密闭容器中进行反应![]() 该反应的反应速率
该反应的反应速率![]() 随时间
随时间![]() 变化的关系如图所示,若
变化的关系如图所示,若![]() 、
、![]() 时刻只改变一个条件,下列说法正确的是
时刻只改变一个条件,下列说法正确的是![]() 填选项序号
填选项序号![]() ______。
______。

![]() 在
在![]() 时,可依据定容容器内气体的压强保持不变判断反应已达到平衡状态
时,可依据定容容器内气体的压强保持不变判断反应已达到平衡状态
![]() 在
在![]() 时,采取的措施可以是升高温度
时,采取的措施可以是升高温度
![]() 在
在![]() 时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
![]() 在
在![]() 时,容器内
时,容器内![]() 的体积分数是整个过程中的最大值
的体积分数是整个过程中的最大值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把质量为mg的铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红而且质量仍为mg的是
A.NaOH溶液B.CH3COOHC.稀HNO3D.CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是![]()
A.医院里常用无水乙醇杀菌、消毒
B.乙醇和乙酸都能与NaOH溶液反应
C.乙酸乙酯中的乙酸可用饱和![]() 溶液除去
溶液除去
D.乙烯、聚乙烯和苯分子中均含有碳碳双键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com