


科目:高中化学 来源:不详 题型:单选题
| A.Li是最活泼金属元素,F是最活泼非金属元素 |
| B.Mg(OH)2碱性比Ca(OH)2强 |
| C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 |
| D.X2+的核外电子数目为10, 则X在第3周期第ⅡA族 |
查看答案和解析>>
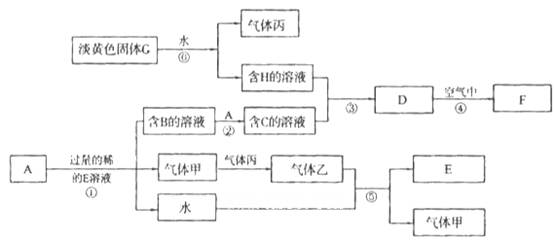
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
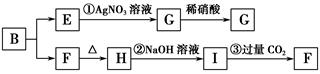
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
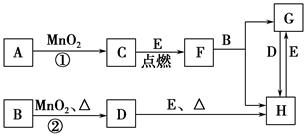
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
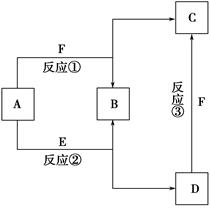
| A.化合物A是一种碱性氧化物 |
| B.图中①②③三个反应均为氧化还原反应 |
| C.化合物D是一种强碱 |
| D.化合物C的水溶液呈酸性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
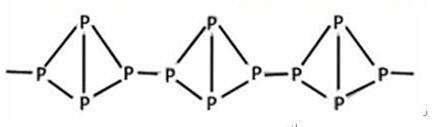 ,
,| A.它在空气中完全燃烧的产物是P2O5 | B.它不溶于水 |
| C.它在常温下呈固态 | D.它与白磷互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
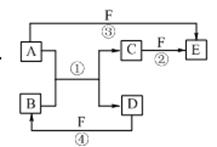
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com