


科目:高中化学 来源: 题型:
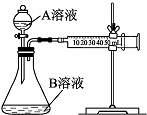 实验小组利用酸性KMnO4溶液与H2C2O4溶液反应研究影响反应速率的因素.
实验小组利用酸性KMnO4溶液与H2C2O4溶液反应研究影响反应速率的因素.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔质量:g?mol-1 |
| B、密度:g?mL-1 |
| C、气体摩尔体积:L |
| D、阿伏加德罗常数:mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| B、硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ |
| C、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O |
| D、向碳酸氢钠溶液中滴加少量稀硝酸:CO32-+2H +=CO2↑ +H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
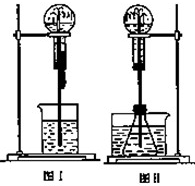 喷泉是一种常见的实验现象(如图),其产生原因是存在压强差.
喷泉是一种常见的实验现象(如图),其产生原因是存在压强差.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com