
| A. | 1.43g/L | B. | 1.90g/L | C. | 2.14g/L | D. | 2.38g/L |
分析 8.8g二氧化碳的物质的量为:n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,根据反应2CO2+2Na2O2=2Na2CO3+O2可知,0.2mol二氧化碳完全反应只生成氧气时,n(O2)=0.1mol,其质量为:m(O2)=32g/mol×0.1mol=3.2g;标准状况下0.1mol氧气的体积为:22.4L/mol×0.1mol=2.24L>1.68L,说明反应后气体中含有部分臭氧,根据ρ=$\frac{m}{V}$计算出反应后混合气体的密度.
解答 解:8.8g二氧化碳的物质的量为:n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,根据反应2CO2+2Na2O2=2Na2CO3+O2可知,0.2mol二氧化碳完全反应只生成氧气时,n(O2)=0.1mol,其质量为:m(O2)=32g/mol×0.1mol=3.2g;标准状况下0.1mol氧气的体积为:22.4L/mol×0.1mol=2.24L>1.68L,说明反应后气体中含有部分臭氧,
则反应后混合气体的密度为:ρ=$\frac{m}{V}$=$\frac{3.2g}{1.68L}$=1.90g/L,
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,明确反应后气体组成为解答关键,注意掌握守恒思想在化学计算中应用方法,解答要细心,特别注意“在一定条件下”几个字,否则易将此气体当作纯氧气.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 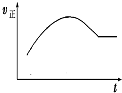 绝热恒容密闭容器中通入A和B,发生反应:2A (g)+B (g)?2C(g),如图为其正反应速率随时间变化的示意图,则该反应为放热反应 | |
| B. | 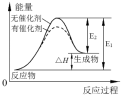 催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率.如图显示的是催化反应与无催化反应过程中的能量关系 | |
| C. |  将BaO2放入密闭真空容器中,反应2BaO2(s)?2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的$\frac{1}{2}$,体系重新达到平衡,体系压强变化如图所示 | |
| D. | 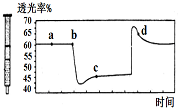 将一定量的NO2充入针筒中后封口,发生反应2NO2 (g)?N2O4(g),如图表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).则c点与a点相比,c(NO2)增大,c(N2O4)减小. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.
ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.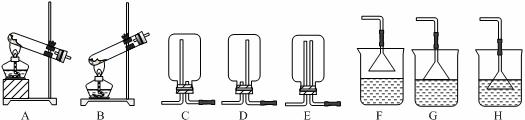
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.
2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
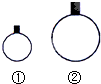
| A. | 常温常压下,相同物质的量的物质,其体积一定相等 | |
| B. | 常温常压下,用等质量的H2、CH4两种气体分别吹出如图所示的两个气球,其中①号气球内气体一定为CH4 | |
| C. | 任何条件下,等物质的量的氮气和一氧化碳所含的分子数、原子数不一定相等 | |
| D. | 1mol金属镁与其他物质发生化学反应,金属镁失去的电子数一定是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
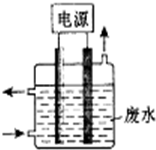
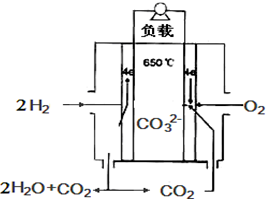 熔融碳酸盐燃料电池,是由多孔陶瓷阴极、多孔陶瓷电解质隔膜、多孔金属阳极、金属极板构成的燃料电池.其电解质是熔融态碳酸盐.如图是用熔融碳酸盐作电解质,氢气和氧气形成的燃料电池,下列说法不正确的是( )
熔融碳酸盐燃料电池,是由多孔陶瓷阴极、多孔陶瓷电解质隔膜、多孔金属阳极、金属极板构成的燃料电池.其电解质是熔融态碳酸盐.如图是用熔融碳酸盐作电解质,氢气和氧气形成的燃料电池,下列说法不正确的是( )| A. | 该电池放电时,负极的反应式为:H2-2e-+CO32-═H2O+CO2 | |
| B. | 该电池中CO32-的为由左边移向右边移动 | |
| C. | 该电池放电时,正极的反应式为:O2+2CO2+4e-═2CO32- | |
| D. | 该电池放电时,当转移4mol e-时正极消耗1mol O2和2mol CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com