
分析 R原子的3p轨道上只有一个未成对电子,则R原子3p轨道上可能含有1个电子或5个电子,据此判断R元素;
X原子在第二电子层上只有一个空轨道,则价层电子排布式为2s22p2,则X是C元素;
Y原子的核电荷数为33,则Y是As元素,根据能量最低原理书写电子排布式,主族元素的电子层数与其周期数相等、最外层电子数与其族序数相等,根据最后排入的电子判断该元素的位置.
解答 解:R原子的3p轨道上只有一个未成对电子,则价层电子排布式为3s23p1或3s23p5,则R为Al元素或Cl元素;
X原子在第二电子层上只有一个空轨道,则价层电子排布式为2s22p2,则X是C元素;
Y原子的核电荷数为33,则Y是As元素,根据能量最低原理知电子排布式1s22s22p63s23p63d104s24p3,主族元素的电子层数与其周期数相等、最外层电子数与其族序数相等,所以As元素位于第四周期第VA族;
故答案为:Al;Cl;C;1s22s22p63s23p63d104s24p3;第四周期第VA族.
点评 本题考查了原子核外电子排布,明确原子结构、元素周期表结构再结合构造原理来分析解答,知道元素在周期表中的位置等知识点是解本题关键,题目难度中等.


 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
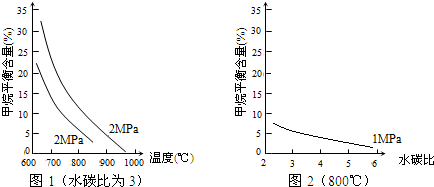
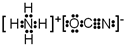 或
或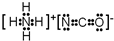 .
. .A、B元素形成的最简单的化合物不能与E2+形成配合物的原因是CH4不能提供孤对电子.
.A、B元素形成的最简单的化合物不能与E2+形成配合物的原因是CH4不能提供孤对电子.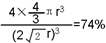 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 外围电子就是最外层电子 | |
| B. | 最外层电子数小于4的元素一定是金属元素 | |
| C. | 过渡元素的最外层电子数一般为1个或2个 | |
| D. | 如果某元素最外层电子数是1个或2个,次外层电子数为18个,此元素是副族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;ZX2的化学式是SiO2.
;ZX2的化学式是SiO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度的下列溶液:①H2CO3、②Na2CO3、③NaHCO3、④(NH4)2CO3:其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3 溶液中加入等体积0.1 mol•L-1NaOH 溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,78g Na2O2的分子数为NA | |
| B. | 标准状况下,22.4L氯气在任何反应中转移电子数均为2NA | |
| C. | 标准状况下,22.4mL H2O中含水分子的个数约为1.24NA | |
| D. | 17g NH3溶于水后溶质NH3的个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏时把温度计插入液面下 | |
| B. | 向银氨溶液中加入几滴乙醛后用酒精灯加热至沸腾制银镜 | |
| C. | 检验卤代烷中的卤素元素可先将卤代烷与NaOH溶液混合加热,然后加入AgNO3溶液,根据生成沉淀的颜色初步确定卤素 | |
| D. | 用乙醇、醋酸和18mol/L的硫酸混合加热制乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7 | |
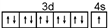
| B. | N原子的轨道表示式: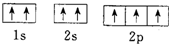 违反了泡利不相容原理 违反了泡利不相容原理 | |
| C. | 电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理 | |
| D. | 电子排布式(23V)1s22s22p63s23p63d34s2违反了洪特规则 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com