
| A. | 用品: 有效成分:NaCl用途:做调味品 有效成分:NaCl用途:做调味品 | |
| B. | 用品: 有效成分:Na2CO3用途:做发酵粉 有效成分:Na2CO3用途:做发酵粉 | |
| C. | 用品: 有效成分:Al(OH)3用途:做抗酸药 有效成分:Al(OH)3用途:做抗酸药 | |
| D. | 用品: 有效成分:Ca(ClO)2用途:做消毒剂 有效成分:Ca(ClO)2用途:做消毒剂 |
分析 A.依据食盐主要成分为氯化钠结合氯化钠用途解答;
B.依据小苏打成分为碳酸氢钠解答;
C.胃舒平主要成分氢氧化铝,氢氧化铝能与盐酸反应;
D.漂白粉主要成分氯化钙、次氯酸钙,有效成分次氯酸钙;
解答 解:A.食盐主要成分为氯化钠,为调味品,故A正确;
B.小苏打成分为碳酸氢钠,碳酸氢钠不稳定,能够分解生成二氧化碳,可做发酵剂,故B错误;
C.胃舒平主要成分氢氧化铝,氢氧化铝能与盐酸反应,消耗盐酸,所以可以用来治疗胃酸过多,故C正确;
D.漂白粉主要成分氯化钙、次氯酸钙,有效成分次氯酸钙,次氯酸钙具有强氧化性,能够杀菌消毒,故D正确;
故选:B.
点评 本题考查了生活中常见物质的成分及用途,熟悉相关物质的性质是解题关键,题目难度不大,注意积累.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2、CO2、CO、NO2都是酸性氧化物 | |
| B. | Na2O、Na2O2、Fe2O3、CuO都是碱性氧化物 | |
| C. | HCI、HClO、HClO3、HClO4都是强酸 | |
| D. | NaOH、KOH、Ba(OH)2都是强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
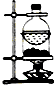 |  | 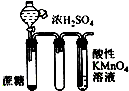 | 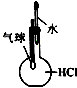 |
| 分离NH4Cl和Ca(OH)2固体 | X为四氯化碳,可用于吸收氨气,并防止倒吸 | 验证浓硫酸的脱水性和强氧化性 | 验证HCl气体在水中的溶解性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
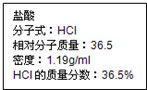 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
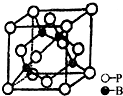 磷是生物体中不可缺少的元素之一,它能形成多种化合物.
磷是生物体中不可缺少的元素之一,它能形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、Al3+、Cl- | B. | K+、SO42-、Ba2+、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | H+、SO42-、HCO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铜绿的主要成分是碱式碳酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对;有 |
| B | 铜表面易形成致密的氧化膜 | 铜容器可以盛放浓硫酸 | Ⅰ对;Ⅱ对;有 |
| C | 铁比铜活泼 | 铆在铜板上的铁钉在潮湿空气中不易生锈 | Ⅰ对;Ⅱ对;有 |
| D | 硫酸铜晶体受热转化为硫酸铜粉末属于风化过程 | 硫酸铜溶液可用作游泳池水的消毒 | Ⅰ错;Ⅱ对;无 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com