(2012?湖南模拟)2011年8月12日,网传云南曲靖市越州镇约5000余吨的重毒化工废料铬渣非法丢放,毒水被直接排放到南盘江中.被污染的水中主要含有Cr
3+,同时还含有少量的Cu
2+、Fe
2+、Fe
3+和Al
3+等,且酸性较强.
Ⅰ.污泥中Cr
+回收与再利用工艺如下(硫酸浸取液中的金属离子主要是Cr
3+,其次是Fe
3+、Al
3+、Ca
2+、Mg
2+):
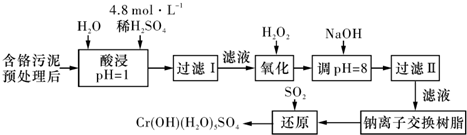
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cu2+ |
Cr3+ |
| 开始沉淀时的pH |
1.9 |
7.0 |
- |
_ |
4.7 |
- |
| 沉淀完全时的pH |
3.2 |
9.0 |
11.1 |
8 |
6.7 |
9(>9溶解) |
(1)实验室用18.4mol?L
-1的浓硫酸配制250mL 4.8mol?L
-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需
250mL容量瓶、胶头滴管.
250mL容量瓶、胶头滴管.
(2)加入H
2O
2的作用是
将滤液Ⅰ中的Cr3+转化为Cr2O72-,以便于与杂质离子分离
将滤液Ⅰ中的Cr3+转化为Cr2O72-,以便于与杂质离子分离
.调节溶液的pH=8是为了除去
Fe3+、Al3+
Fe3+、Al3+
离子.
(3)还原过程发生以下反应,请配平:
1
1
Na
2Cr
2O
7+
3
3
SO
2+
11
11
H2O
H2O
═
2
2
Cr(OH)(H
2O)
5 SO
4+
Na2SO4
Na2SO4
Na
2SO
4Ⅱ.工业废水中常含有一定量的
Cr2和
Cr,它们会对人类及生态系统产生很大损害,必须进行处理.其中一种处理方法为电解法,该法用Fe做电极,电解含
Cr2的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)
3沉淀.
阳极的电极反应式为
Fe-2e-═Fe2+
Fe-2e-═Fe2+
.
电解时能否用Cu电极来代替Fe电极?
不能
不能
(填“能”或“不能”),理由是
因阳极产生的Cu2+不能使Cr2O72-还原到低价态
因阳极产生的Cu2+不能使Cr2O72-还原到低价态
.