
【题目】将铜棒和锌棒用导线连接后插入稀硫酸溶液中,下列叙述中正确的是( )
A.该装置能形成原电池,其中锌是负极
B.该装置能形成原电池,其中铜是负极
C.该装置不能形成原电池
D.以上说法均不正确
科目:高中化学 来源: 题型:
【题目】乙酰苯胺是较早使用的一种解热镇痛药,可由苯胺和乙酸反应制备:
![]()
已知:① 苯胺易被氧化;
② 乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点 | 沸点 | 溶解度(20 ℃) |
乙酰苯胺 | 114.3 ℃ | 305 ℃ | 0.46 |
苯胺 | -6 ℃ | 184.4℃ | 3.4 |
醋酸 | 16.6 ℃ | 118 ℃ | 易溶 |
实验步骤如下:

步骤1:在50 mL圆底烧瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少许锌粉,依照右图装置组装仪器。
步骤2:控制温度计示数约105 ℃,小火加热回流1 h。
步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
请回答下列问题:
(1)步骤1中加入锌粉的作用是________________ 、起着沸石的作用。
(2)步骤2中控制温度计示数约105 ℃,接引管流出的主要物质是________________,若温度过高,会导致________________。刺形分馏柱中,由下到上,温度逐渐________________(填“升高”、“降低”或“不变”)。
(3)步骤3中抽滤装置所包含的仪器除减压系统外,还有吸滤瓶、________________(填仪器名称)。
(4)步骤3得到的粗产品可采取重结晶的方法进一步提纯,操作步骤是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g)![]() CH2=CH2(g) +4H2O(g)。已知温度对CO2的平衡转化率和催化剂催化效率的影响如右下图。下列说法正确的是
CH2=CH2(g) +4H2O(g)。已知温度对CO2的平衡转化率和催化剂催化效率的影响如右下图。下列说法正确的是

A. M点的正反应速率v正大于N点的逆反应速率v逆
B. 若投料比n(H2) :n(CO2) =4:1,则图中M点己烯的体积分数为5.88%
C. 250℃,催化剂对CO2平衡转化率的影响最大
D. 当温度高于250℃,升高温度,平衡逆向移动导致催化剂的催化效率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向KBr和KI的混合溶液中通入足量的氯气后,溶液蒸干后并将剩余物灼烧,最后残余的物质是( )
A.KCl
B.KCl和I2
C.KCl和Br2
D.KCl和KBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是( )

A. 莽草酸的分子式为C7H12O5
B. 两种酸均能与溴的CCl4发生加成反应
C. 鞣酸分子与莽草酸分子相比多了两个碳碳双键
D. 等物质的量的两种酸与足量金属钠反应产生氢气的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)乙炔是一种重要的化工原料,最新研制出的由裂解气(H2、CH4、C2H4)与煤粉在催化剂条件下制乙炔,该生产过程是目前清洁高效的煤化工过程。已知:发生的部分反应如下(在25℃、 101 kPa时),CH4、C2H4 在高温条件还会分解生成炭与氢气:
①C (s) +2H2(g)![]() CH4(g) △H1=-74.85kJmol-1
CH4(g) △H1=-74.85kJmol-1
②2CH4(g)![]() C2H4(g) +2H2(g) △H2=340.93kJmol-1
C2H4(g) +2H2(g) △H2=340.93kJmol-1
③C2H4(g)![]() C2H2(g) +H2(g) △H3=35.50kJmol-1
C2H2(g) +H2(g) △H3=35.50kJmol-1
请回答:
(1)依据上述反应, 请写出 C 与 H2化合生成 C2H2 的热化学方程式:______________。
(2)若以乙烯和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有乙烯、乙炔、氢气等。图1 为乙炔产率与进料气中 n(氢气)/n(乙烯)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是______________。
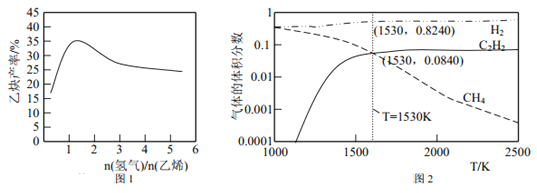
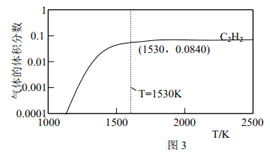
(3)图 2 为上述诸反应达到平衡时各气体体积分数和反应温度的关系曲线。
①乙炔体积分数在1530℃之前随温度升高而增大的原因可能是_______________;1530℃之后,乙炔体积分数增加不明显的主要原因可能是_______________。
②在体积为1L的密闭容器中反应,1530℃时测得气体的总物质的量为1.000 mol,则反应C2H4(g)![]() C2H2(g) +H2(g) 的平衡常数 K=_______________。
C2H2(g) +H2(g) 的平衡常数 K=_______________。
③请在图3中绘制乙烯的体积分数和反应温度的关系曲线__________。
(二)当今,人们正在研究有机锂电解质体系的锂-空气电池,它是一种环境友好的蓄电池。放电时电池的总反应为:4Li+O2===2Li2O。在充电时,阳极区发生的过程比较复杂,目前普遍认可的是按两步进行,请补充完整。电极反应式: ________________________和 Li2O2-2e-=2Li++O2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在生活及工业中运用广泛。
(1)氮氧化物排放是形成臭氧层空洞重要成因之一,氮氧化物破坏臭氧层原理为:i. NO+O3![]() NO2+O2 K1 ii. NO2+O
NO2+O2 K1 ii. NO2+O![]() NO+O2 K2
NO+O2 K2
则反应O3+O![]() 2O2 的平衡常数K=_____(用K1、K2表示)。NO在该反应过程中的作用是_______。
2O2 的平衡常数K=_____(用K1、K2表示)。NO在该反应过程中的作用是_______。
(2)N2H4是火箭发射的助燃剂。N2H4与氨气相似,溶于水生成弱碱N2H4·H2O,写出N2H4·H2O的电离方程式___________。
(3)已知t ℃时,KW=1×10-13,则t ℃_______25℃(填“>”、“<”或“=”)。在t ℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com