
| 操作和现象 | 结论 | |
| A | 向氯水中加入硝酸银溶液,有白色沉淀产生 | 氯水中已无Cl2 |
| B | 将SO2通入酸性高锰酸钾溶液,溶液紫色褪去 | SO2具有漂白性 |
| C | 向FeCl3和CuCl2混合溶液中加入少量铁粉,没有红色固体析出 | 氧化性:Fe3+>Cu2+ |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
分析 A、氯气溶于水,部分与水发生反应:Cl2+H2O?HCl+HClO,该反应是可逆反应,所以氯水中含有的微粒是:分子:Cl2、HClO、H2O;离子:H+、Cl-、ClO-、OH-,依据存在微粒的性质解答;
B、将SO2通入酸性高锰酸钾溶液,溶液紫色褪去,说明二氧化硫的还原性;
C、向FeCl3、CuCl2混合溶液加铁粉,先发生Fe与铁离子的反应;
D、能和氯化钡反应生成白色沉淀的离子有硫酸根离子、银离子.
解答 解:A、向氯水中加入硝酸银溶液,有白色沉淀产生,只能说明溶液中存在氯离子,故A错误;
B、将SO2通入酸性高锰酸钾溶液,溶液紫色褪去,说明二氧化硫的还原性,而不是漂白性,故B错误;
C、向FeCl3、CuCl2混合溶液加铁粉,先发生Fe与铁离子的反应生成亚铁离子,再发生Fe与氯化铜反应,则说明氧化性:Cu2+<Fe3+,故C正确;
D、向某溶液中先滴加硝酸酸化,硝酸具有强氧化性,溶液中若是亚硫酸根离子,被硝酸氧化为硫酸根离子,再滴加BaCl2溶液,有白色沉淀生成,溶液中不一定含有银离子,故D错误;
故选C.
点评 本题考查化学实验方案的评价,涉及氯水、还原性、氧化还原反应、离子检验等,侧重反应原理及物质性质的考查,为高频考点,明确物质性质是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | y在元素周期表的位置是第二周期IVA族 | |
| B. | d元素常见离子的半径大于f元素常见离子的半径 | |
| C. | x,、z元素能组成一种四原子共价化合物,其电子式可以表示为 | |
| D. | e、f的最高价氧化物对应的水化物可以相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
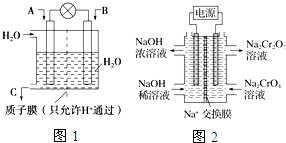 SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径.
SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 呈酸性的雨水就是酸雨 | B. | “雷雨肥庄稼”符合科学道理 | ||
| C. | 光化学烟雾是由二氧化硫引起的 | D. | 臭氧层破坏与氮氧化物无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN溶液 | B. | NaOH溶液 | C. | 氨水 | D. | 石蕊试液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥⑦ | B. | ②④⑥⑦ | C. | ④⑤⑥ | D. | ①③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Q>W>Z>Y | |
| B. | 元素Y、Q的气态氢化物稳定性:Q>Y | |
| C. | 元素Z、W、Q的最高价氧化物对应水化物相互间能发生反应 | |
| D. | Y与X、Y与Z形成的化合物化学键类型相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 与足量的澄清石灰水反应的现象不同 | |
| B. | 通入BaCl 2溶液时现象相同 | |
| C. | 通入Ba(NO3)₂溶液时现象相同 | |
| D. | 通入石蕊溶液时现象相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com